Radiology:痴呆的分子病理成像进展
2023-02-24 brainnew神内神外 brainnew神内神外 发表于安徽省
PET分子成像技术不仅可以帮助显示阿尔茨海默症的病理学特征,评估帕金森病中多巴胺能终末的丢失,而且新的神经炎症和突触密度示踪剂的发展进一步允许阐明阿尔茨海默病症的分子病理学特征。
导读:
由于阿尔茨海默病的病理过程通常在症状明显前几十年就开始了,因此全球范围内阿尔兹海默病发病率的不断上升,对医疗保健提供者在该病的相对早期阶段进行诊断检查提出了很高的要求。PET分子成像不仅可以帮助显示阿兹海默病的病理学特征,评估帕金森病中多巴胺能终末的丢失,而且新的神经炎症和突触密度示踪剂的发展进一步允许阐明阿尔兹海默病症的分子病理学特征。近期《Radiology》(IF=7.931)期刊上发表了题为“Molecular Imaging Approaches in Dementia”的文章,作者认为,现有的和新兴的PET示踪剂在诊断阿尔茨海默病方面具有重要价值,以及它们作为阿尔茨海默病研究和临床试验预后指标的价值。
 全球范围内痴呆的发病率正在上升,部分原因是预期寿命的延长。对痴呆认识的提高对医疗保健提供者提出了很高的要求,要求他们在该疾病相对较早的阶段进行诊断检查。PET/SPECT分子成像技术可以在症状出现前几十年检测病理生理变化,PET/SPECT分子成像能够显示阿尔茨海默病中的淀粉样蛋白和tau蛋白沉积,CT特别是MRI可为血管性痴呆和各种原发性神经退行性疾病提供重要的诊断线索。由于MRI在提供特异性疾病诊断方面的局限性,人们越来越需要建立更明确的分子诊断。虽然脑脊液(CSF)检测可以提供相关信息(例如,Aβ-淀粉样蛋白和tau蛋白的病理发现),但该过程是侵入性的,在标准化测量方面存在挑战。与新兴的血清标记物一样,脑脊液分析不能提供病理表现的空间分布信息,也不能提供SPECT或PET可以显示的多巴胺转运体状态信息。即使在临床上可能患有AD的个体中,Aβ-PET也可能导致诊断确定性和患者治疗的显著改变,而多巴胺成像可以支持路易体(DLB)痴呆或帕金森病(PD)痴呆的诊断。利用PET对痴呆进行分子成像是一个迅速发展的领域,包括tau蛋白、神经炎症和突触密度的示踪剂。文中作者通过概述已建立或研究新的神经炎症和突触密度示踪剂将进一步阐明痴呆疾病的潜在分子病理学特征。
全球范围内痴呆的发病率正在上升,部分原因是预期寿命的延长。对痴呆认识的提高对医疗保健提供者提出了很高的要求,要求他们在该疾病相对较早的阶段进行诊断检查。PET/SPECT分子成像技术可以在症状出现前几十年检测病理生理变化,PET/SPECT分子成像能够显示阿尔茨海默病中的淀粉样蛋白和tau蛋白沉积,CT特别是MRI可为血管性痴呆和各种原发性神经退行性疾病提供重要的诊断线索。由于MRI在提供特异性疾病诊断方面的局限性,人们越来越需要建立更明确的分子诊断。虽然脑脊液(CSF)检测可以提供相关信息(例如,Aβ-淀粉样蛋白和tau蛋白的病理发现),但该过程是侵入性的,在标准化测量方面存在挑战。与新兴的血清标记物一样,脑脊液分析不能提供病理表现的空间分布信息,也不能提供SPECT或PET可以显示的多巴胺转运体状态信息。即使在临床上可能患有AD的个体中,Aβ-PET也可能导致诊断确定性和患者治疗的显著改变,而多巴胺成像可以支持路易体(DLB)痴呆或帕金森病(PD)痴呆的诊断。利用PET对痴呆进行分子成像是一个迅速发展的领域,包括tau蛋白、神经炎症和突触密度的示踪剂。文中作者通过概述已建立或研究新的神经炎症和突触密度示踪剂将进一步阐明痴呆疾病的潜在分子病理学特征。
AD中淀粉样Aβ蛋白和Tau蛋白成像
神经退行性疾病的病理过程通常在症状明显前几十年开始。临床上无法检测病理过程,这就排除了在症状出现前阶段采用疾病缓解疗法进行早期干预的可能性,而通过阻止神经元丢失,这种疗法可能会获得最大的益处。因此,寻求诊断范式的改变,诊断不再是识别神经元衰竭的体征和症状,表明中枢代偿机制已经耗尽,广泛的突触和神经元损伤已经存在于特定生物标志物的无创检测中。病理过程背后的特殊特征。
Aβ-淀粉样蛋白和tau蛋白病理发现的体内成像的引入,通过提供脑内局部或整体Aβ-淀粉样蛋白和tau蛋白负担的可重复性陈述,改变了AD的评估。
Aβ-淀粉样蛋白成像
Aβ-淀粉样斑块是AD的标志性脑损伤之一,已经开发了几种Aβ-淀粉样蛋白选择性放射示踪剂,用于在体内评估大脑中Aβ-淀粉样蛋白的病理发现(表1)。
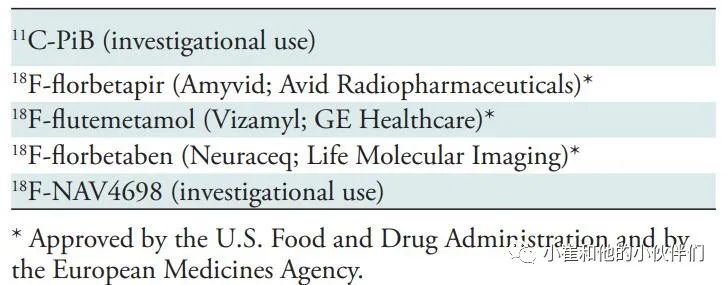
表1 目前使用的Aβ-淀粉样蛋白示踪剂
 使用碳11(11C) PiB(图1)进行初始人类 Aβ-淀粉样蛋白成像研究。为了克服11C 衰变半衰期短的局限性,研制了几种标有氟18(18F)(半衰期110分钟)的抗体淀粉样蛋白示踪剂。其中最成功的是18F-florbetaben,18F-flutemetamol ,18F-florbetapir (图1) ,它们与Aβ-淀粉样蛋白神经病理结果、临床有效性有很高的相关性,并且已经在美国、欧洲和日本被批准用于临床。第三代示踪剂18F-nav4694具有与PiB 非常相似的特性,也主要用于研究研究(图1)。
使用碳11(11C) PiB(图1)进行初始人类 Aβ-淀粉样蛋白成像研究。为了克服11C 衰变半衰期短的局限性,研制了几种标有氟18(18F)(半衰期110分钟)的抗体淀粉样蛋白示踪剂。其中最成功的是18F-florbetaben,18F-flutemetamol ,18F-florbetapir (图1) ,它们与Aβ-淀粉样蛋白神经病理结果、临床有效性有很高的相关性,并且已经在美国、欧洲和日本被批准用于临床。第三代示踪剂18F-nav4694具有与PiB 非常相似的特性,也主要用于研究研究(图1)。
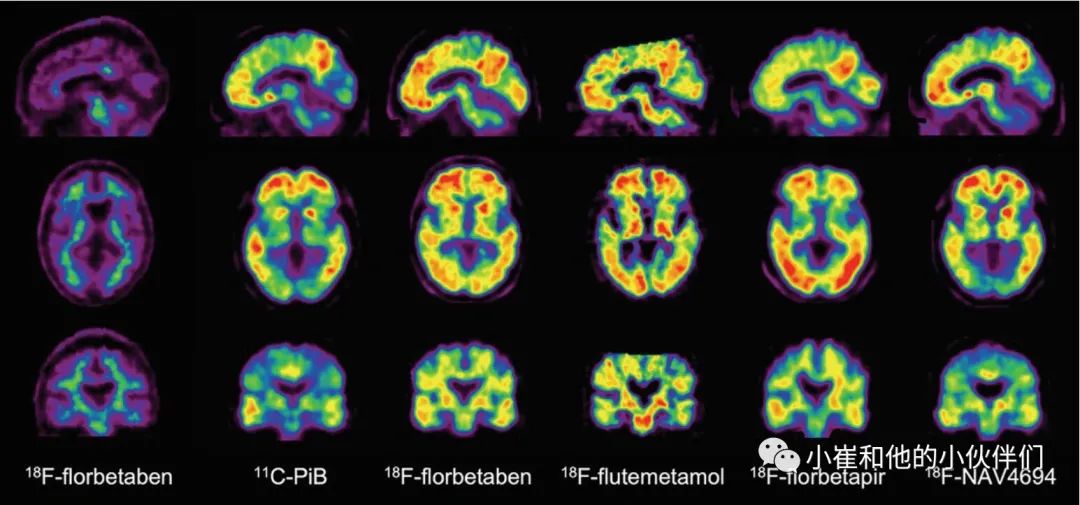
图1 使用几种Aβ-淀粉样蛋白选择性放射示踪剂获得的Aβ蛋白成像
Aβ-淀粉样蛋白成像的几个应用已经实现(表2),所有这些示踪剂在AD患者和年龄匹配的对照组患者之间显示了显著的差异(图1)。Aβ-淀粉样蛋白成像也有助于鉴别诊断有不典型痴呆表现的患者,如原发性进行性失语症的logopenic (Alzheimer)变体的语言表现。虽然在额颞叶变性或散发性克雅氏病患者中,通常皮质中没有Aβ-淀粉样示踪物滞留,但其他神经退行性疾病,如路易体(DLB)痴呆和大脑淀粉样血管病,可能表现为Aβ-淀粉样沉积。DLB患者通常表现出与AD患者相似的模式,而脑淀粉样血管病中可观察到后皮层 Aβ-淀粉样沉积。
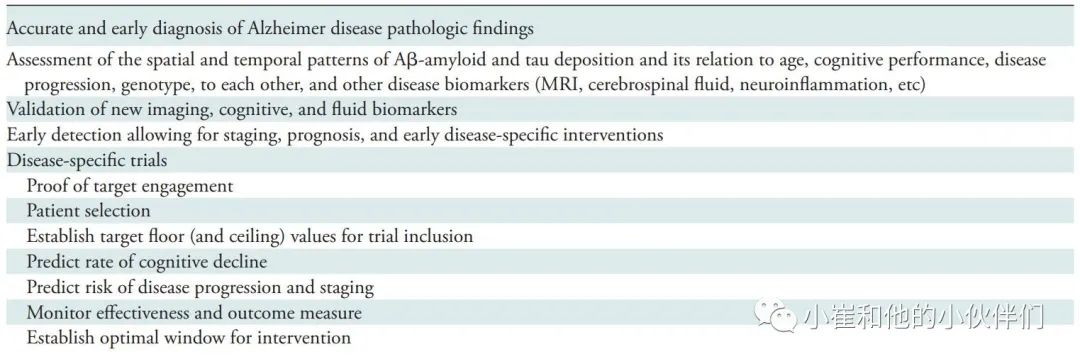
表2 Aβ-淀粉样蛋白和Tau成像的应用
早期Aβ-淀粉样蛋白的积累在临床应用方面具有挑战性,因为Aβ-淀粉样蛋白阳性扫描可能反映临床上无症状的AD病理表现,这可能比痴呆发病早15-20年。在诊断环境中,对有症状的病人进行Aβ-淀粉样蛋白PET扫描的结果,因此信息量更大,因为它明确排除了AD。在大多数研究中,20%-30%的临床诊断为AD的患者和约30%- 50%的轻度认知障碍(MCI)患者的 Aβ-淀粉样蛋白PET扫描显示正常,这就有效的排除了AD为病因。20%-60% 到记忆诊所就诊的患者,Aβ-淀粉样蛋白PET扫描导致治疗的改变,后者主要是由于乙酰胆碱酯酶抑制剂药物的改变。尽管Aβ-淀粉样蛋白负荷与老年人群和MCI患者的记忆障碍和认知功能下降的高风险相关,但它与AD患者的认知功能障碍、突触活动和神经退行性变没有很强的相关性,可能是因为Aβ-淀粉样蛋白积累已经达到了平台期。考虑到所有这些因素,很明显, Aβ-淀粉样蛋白在大脑中的沉积不是正常衰老的一部分,而是导致AD认知能力下降的早期所必要的,尽管不是充分的原因。这表明参与其他下游机制,可能是由Aβ-淀粉样蛋白引发的,如神经原纤维缠结形成、神经炎症、突触衰竭和最终神经元丢失。
选择性tau蛋白成像
最近增加的评估神经退行性蛋白质病的tau显像。尽管有特殊的tau的生理病理特征,在过去的几年里,随着几种选择性tau示踪剂广泛应用于研究,新的tau示踪剂开始应用(表3)。早期使用最广泛的选择性tau示踪剂是18F-flortaucipir。其他包括THK示踪系列(18F-THK5317和18F-THK5351)(46,47)和碳11吡啶基-丁二烯基苯并噻唑。tau成像的大部分研究和潜在的临床应用与Aβ-淀粉样蛋白成像相似(图2),而其他的应用,如跟踪疾病进展,疾病分期,或作为认知的替代标记,与 tau 蛋白关系更为密切。第一代tau示踪剂的相关问题之一是在基底神经节、脉络膜丛或黑质“脱靶”结合。在18F-flortaucipir的特殊病例中,已经证明Aβ-淀粉样蛋白阴性和有正常认知能力的个体中60%的信号是非特异性的。新一代示踪剂,如18F-RO948或18F-GTP1,表现出较少明显的脱靶结合,而其他示踪剂,如18F-MK6240(图3)或18F-PI2620,表现出不同的脱靶模式。与AD患者相比,Aβ-淀粉样蛋白阴性的对照组患者较低的MK6240或PI2620保留产生了较高的效果,显示出这些示踪剂可能适合于检测大脑中tau蛋白水平的早期和微妙的增加。此外,PI2620已被证明与4Rtau沉积结合,这可能有助于4Rtau病变的早期和鉴别诊断,如进行性核上麻痹(PSP)和皮质基底变性。
表3 目前使用的Tau示踪剂
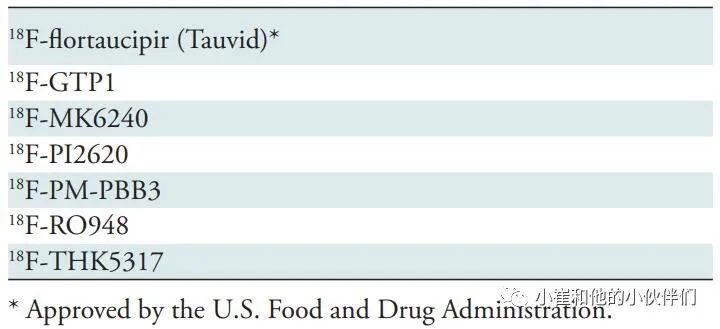
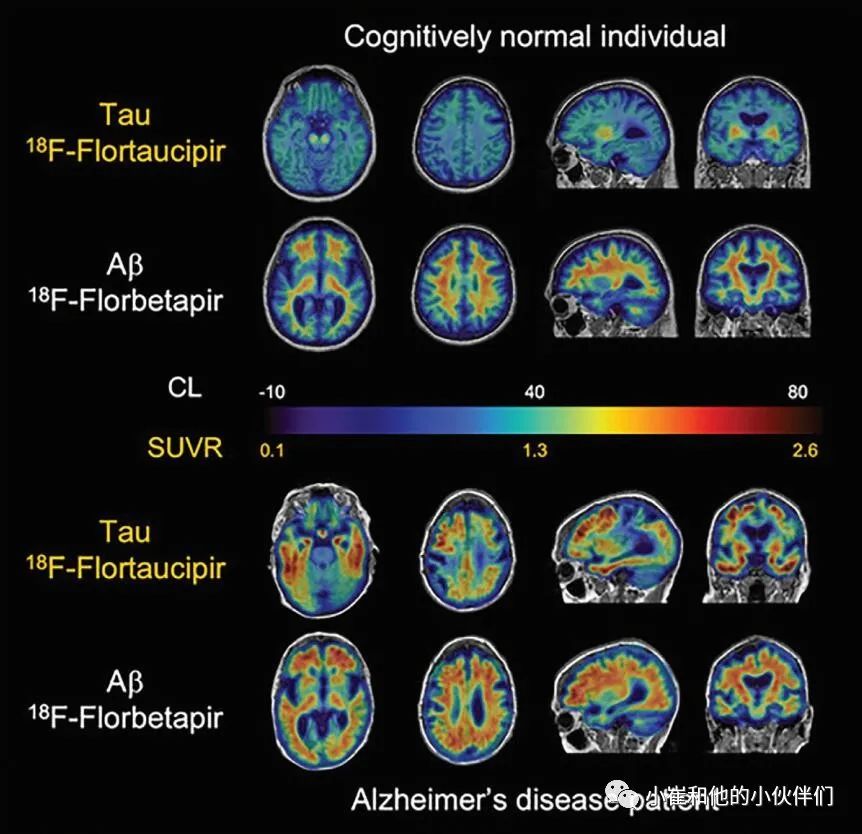
图2 使用18F-flortaucipir示踪剂获得的Aβ和Tau蛋白PET图像
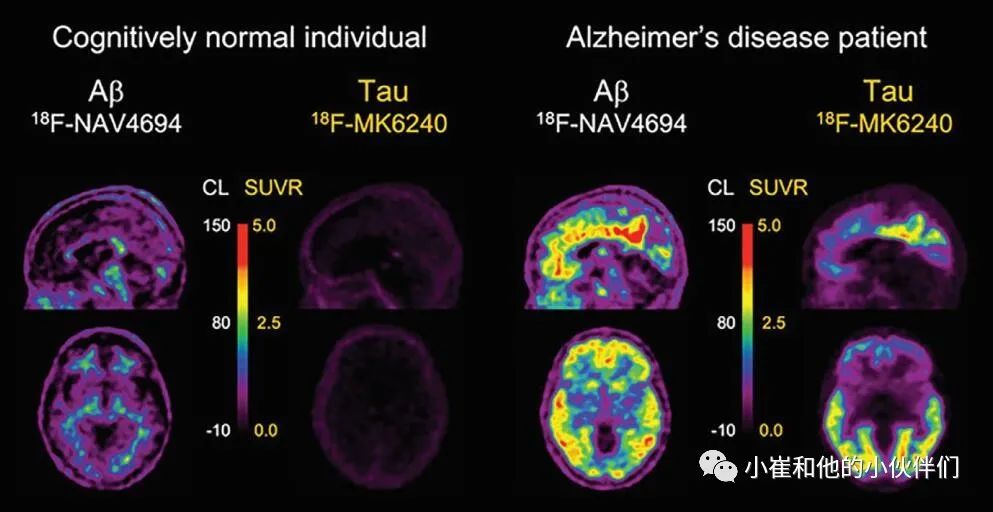 图3 分别用 (18F) NAV4694 (Ab)和18F- mk6240 (tau)获得的Aβ-淀粉样蛋白和Tau蛋白PET图像
图3 分别用 (18F) NAV4694 (Ab)和18F- mk6240 (tau)获得的Aβ-淀粉样蛋白和Tau蛋白PET图像
Aβ-淀粉样蛋白成像研究表明,大脑中Aβ-淀粉样蛋白的整体数量比局部Aβ-淀粉样蛋白的分布更具有相关性,是认知能力下降的早期驱动因素。相反,死后和最初的tau 蛋白成像研究表明,大脑中 tau 蛋白沉积物的地形分布可能更相关,与神经退行性疾病和认知能力下降更密切相关。成像技术已广泛应用于AD。成像研究与脑脊液和/或血浆成分形成鲜明对比,可以检查大脑中 tau 沉积物的固定空间分布。同时,在AD患者中,PET显示了高浓度的示踪剂滞留在内侧颞叶(MTL) ,颞下叶和颞中叶,喉部和边缘上回,以及颞枕叶,下顶叶,后扣带回,不同程度地累及额叶,主要是背外侧前额叶。虽然在症状前患者中可以观察到内侧颞叶的高示踪剂保留,但是有轻度认知障碍症状和/或痴呆症状的患者表现为新皮质区受累。同时,tau成像可以区分AD的不同病理亚型: 边缘型、典型型和海马保留型 (图4)。
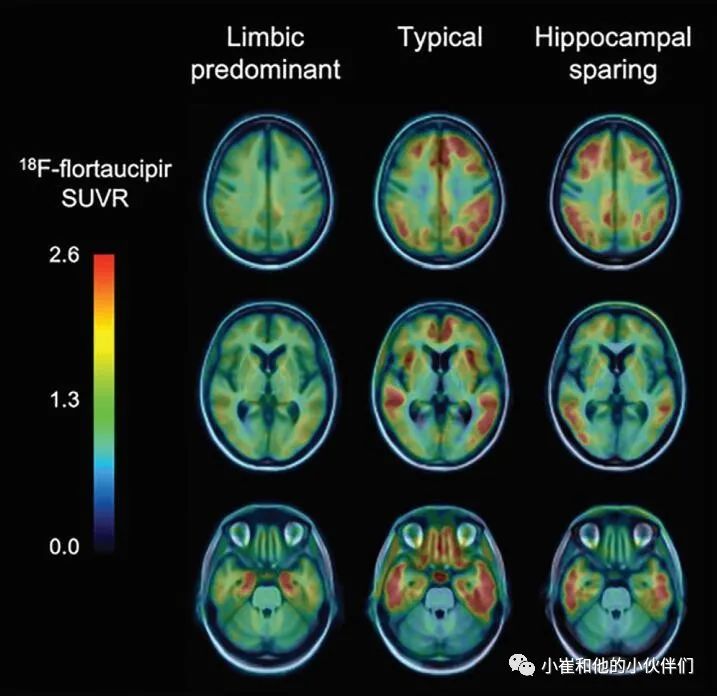 图4 Tau成像有助于识别阿尔茨海默病(AD)的病理亚型
图4 Tau成像有助于识别阿尔茨海默病(AD)的病理亚型
Tau蛋白与神经元损伤的标志物如18f 氟代脱氧葡萄糖(fdg)或皮质灰质萎缩有密切关系,能够预测临床进展和神经退行性疾病。Tau蛋白成像揭示了tau蛋白沉积和认知之间的关系,Aβ-淀粉样蛋白阳性的个体,皮质tau蛋白的增加与认知领域损伤的增加有关。一些研究表明,在认知正常的老年对照患者和AD患者之间,tau示踪剂保留存在显著差异,在非典型AD患者中,PiB评估的18F-flortaucipir区域保留-而不是Aβ-淀粉样蛋白,与临床表型相匹配。尽管绝大多数AD患者同时具有高ab -淀粉样蛋白和高tau蛋白,tau蛋白PET具有高度特异性,可将AD与其他神经退行性疾病区分开来,在临床上诊断为AD的Aβ-淀粉样蛋白升高的患者中,15%-25%的患者皮质tau示踪剂滞留水平低于阈值。有趣的是,有症状的突变携带者大脑中的tau蛋白水平比同样程度认知障碍的散发性AD患者高得多。同样,早发AD患者的tau水平高于晚发AD患者。
疾病的生物标志物分类
最近,一种结合生物化学和神经成像生物标志物的多模态方法被实施,建立了疾病的生物学定义,根据三种标记物诊断AD的研究标准如下: 那些特异性于Aβ -淀粉样蛋白(ab -淀粉样蛋白成像,CSF Aβ1-42),特异性于tau蛋白(tau成像,CSF p-tau),以及反映神经元损伤的非特异性生物标志物(脑脊液和/或血浆中神经丝光升高,通过FDG PET评估ad样葡萄糖低代谢和/或结构MRI测量的脑萎缩),并归类为“神经变性”。在新的淀粉样蛋白、Tau和(神经变性)生物标志物框架中实施的生物标志物的使用,也指导了疾病特异性治疗试验的方法,无论是作为目标参与的证明、患者选择或结果测量,最终允许更短的试验和更小的样本量。最近的研究在基于人群的队列研究、记忆临床人群和认知正常个体中验证了AT(N)框架,也为纵向认知结果提供了初步证据。由于研究人员观察到症状前期和症状期的病理过程已经持续数十年,因此有必要进行大规模的研究,以追踪不同疾病阶段个体的生物标志物和神经心理学特征。
绝大多数Aβ-淀粉样蛋白和tau蛋白PET研究使用短(20-30分钟)静态扫描来测量示踪剂结合。静态扫描的普及是可以理解的,因为它们相对容易获取,对病人友好,对病人运动不太敏感,所有这些都需要有限的昂贵和稀缺的扫描时间。脑PET研究中静态扫描的结果测量通常是标准化摄取值比(SUVR)(图5),这是皮质摄取归化到参考区摄取的结果,参考区被认为没有特异性结合。SUVR的缺点是,它是一种半定量的测量方法,对患者之间的差异尤其是示踪剂的流入和流出非常敏感。这使得SUVR对脑血流变化敏感,脑血流变化每天都不同,但也会随着AD疾病进展而发生。这意味着在预定义时间窗之外的获取(在临床实践中经常发生)可能会产生不同的结果。
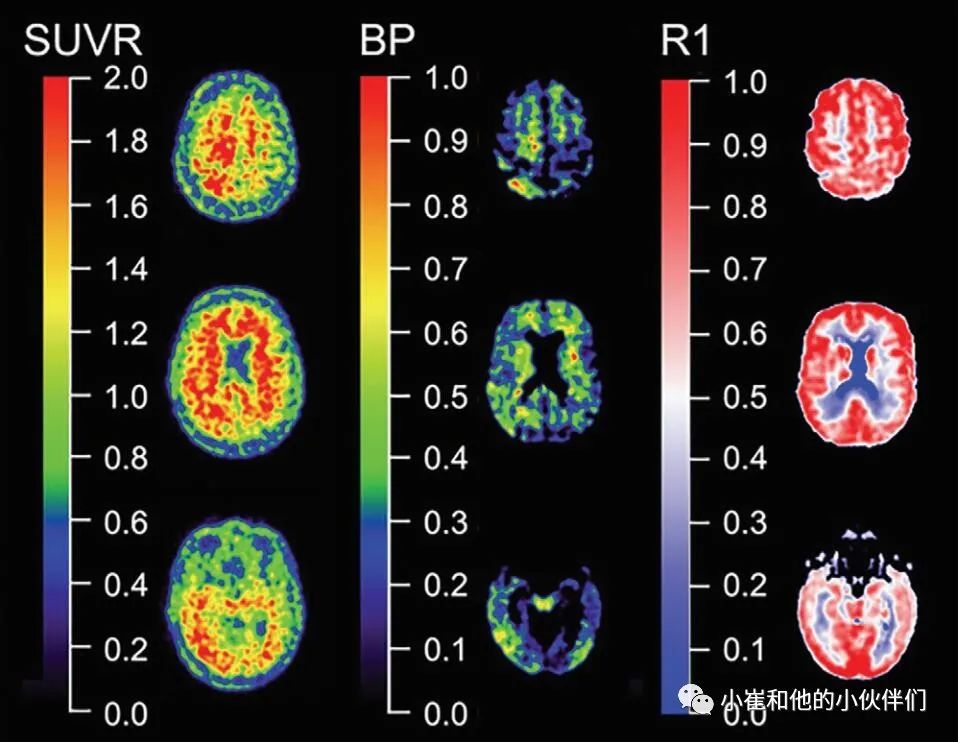
图5 定量和半定量成像
更多的定量方法(占了这些因素的大多数)需要动态成像。最常用的定量模型,如简化参考组织模型、参考参数映射或Logan图形分析,分别产生不可取代结合势(图5)或分布体积比。有趣的是,在PiB的直接比较中,发现SUVR高估了不可取代结合电位的10%-13%。虽然 suvr 的固有偏差也依赖于特定结合的数量,但用 PiB,flor-betapir和 flortucipir进行的测试-再测试重复性研究与不可置换结合位相比较表明,两种测量方法之间有良好的相关性,表明 SUVR 对特定结合给出了合理的估计。因此,SUVR 可以用于评估Aβ-淀粉样蛋白和 tau蛋白状态(例如,高或低Aβ-淀粉样蛋白 /或 tau蛋白) ,或者在不需要准确定量特异性结合的横断面研究中。然而,这并不能转移到纵向研究中,特别是在AD患者中,因为萎缩和血流量随着时间的推移会出现差异,这是由于疾病的自然时间过程。
多巴胺能成像
与痴呆相关的神经退行性疾病也可能影响多巴胺能系统。这通常发生在路易体疾病,如帕金森、帕金森伴痴呆和DLB,以及其他可能与痴呆相关的帕金森综合征,如皮质基底变性、PSP和多系统萎缩(MSA)。
黑质纹状体多巴胺能系统的完整性可以通过分子成像技术得到最好的评价。许多SPECT(图6)和PET(图7)示踪剂针对多巴胺能突触的不同靶点存在,在突触前末端多巴胺转运体(DATs)和二羟基苯丙氨酸(DOPA)活性是临床最常研究的靶点。
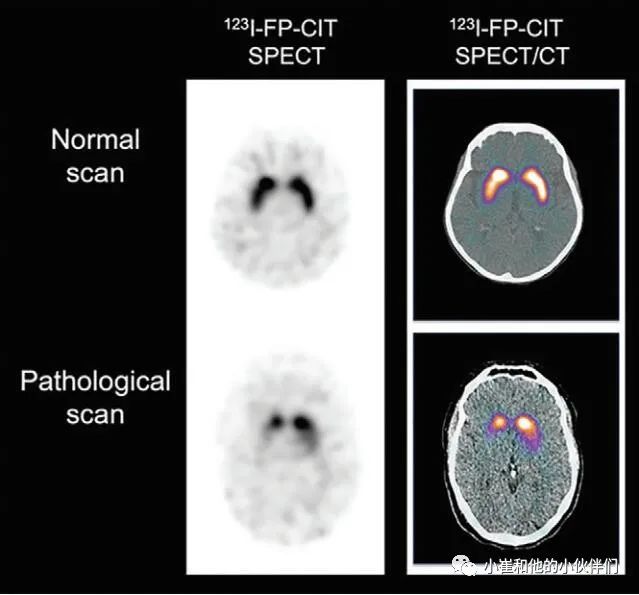 图6 多巴胺能SPECT显像
图6 多巴胺能SPECT显像
DAT成像
在针对 dats 的示踪剂中,123I-FP-CIT被美国食品和药物管理局和欧洲药物管理局批准用于测试路易身体疾病和帕金森综合征中的多巴胺能神经元完整性。示踪结合的恢复与纹状体通路的完整性有关,即多巴胺能神经元密度和轴突功能障碍,而不是α突触核蛋白、 tau 蛋白或Aβ淀粉样蛋白病理结果 (图7)。
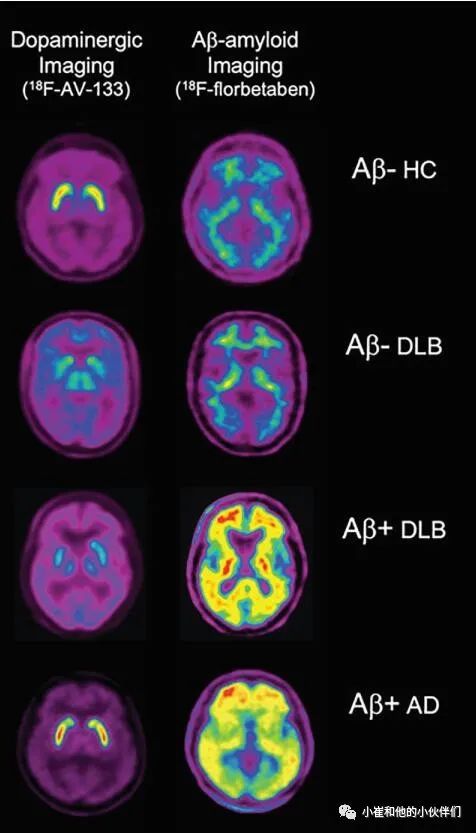
图7 18FAV-133和18F florbetaben Aβ成像的VMAT2的比较
多巴胺能神经末梢多巴胺脱羧酶的活性
18F-FDG DOPA PET允许测量神经末梢的多巴脱羧酶活性,该活性随着黑质纹状体通路的变性和DAT的减少而降低。然而,值得注意的是,这种效应的大小往往小于DAT SPECT,可能是因为在疾病早期阶段多巴胺转化为多巴胺的代偿性上调。不同情况下观察到的异常模式总体上与DAT成像中观察到的变化相当。
神经炎症和突触密度成像
神经炎症在不同的蛋白质疾病的发病机制中起着积极的作用,这强烈地激发了对早期炎症过程及其在疾病进展中可能的因果作用的更深层次的理解。在死后的AD脑组织中,星形胶质细胞和小胶质细胞出现在Aβ-淀粉样斑块附近,表明其在AD的炎症过程中起作用。
已有研究表明,神经炎症可发生在大脑中显著的ab -淀粉样蛋白沉积之前,并可能在清除Aβ-淀粉样蛋白方面具有神经保护作用,但也可能导致神经毒性。大多数关于神经炎症PET成像的研究旨在观察小胶质细胞的激活,通过翻译蛋白18 kDa (TPSO)表达的升高来测量,该蛋白在激活的星形胶质细胞中也升高。11CPK1195是使用最广泛的TPSO PET示踪剂,尽管低脑渗透率和高非特异性结合导致了第二代TPSO示踪剂的开发,包括11CPBR28、18F-DPA-714、18F-FEPPA、11C-DAA1106和18F-GE180。些关于11C-PK11195的研究显示AD患者的皮质小胶质细胞激活增加,而一些研究报告与对照组相比,11C-PK11195的结合没有增加。
据报道,早发AD患者中11C-PBR28的结合水平高于晚发AD。有报道称,与认知功能快速下降的患者相比,认知功能缓慢下降的患者中18F-DPA-714结合增加。MCI和AD患者的大脑皮层11CPK11195结合与tau蛋白和ab -淀粉样蛋白沉积呈正相关。第二代TPSO示踪剂的一个复杂因素是TPSO多态性的存在导致研究人群中结合物的高低。一些非TPSO神经炎症性PET示踪剂,包括靶向大麻素2型受体的11C-NE40和靶向P237受体的11C-JNJ717和11C-SMW130,目前正在探索中。
11C-DED与单胺氧化酶B结合,后者在活化的星形胶质细胞中过表达。11CDED最初被用作PET示踪剂,用于观察一些中枢神经系统疾病中的星形细胞增多,包括癫痫、克雅氏病和肌萎缩性侧索硬化症。与AD痴呆患者相比,早期AD患者的11C-DED结合显著升高(图8)。常染色体显性AD的症状前携带者在预期的临床AD发病前17年可检测到11C-DED。纵向研究显示, 11C-PiB测定的ab -淀粉样蛋白沉积增加,而11CDED测定的星形细胞增多下降。常染色体显性遗传携带者星形胶质细胞数的纵向下降与FGD测定的进行性高代谢显著相关,提示星形胶质细胞可能部分反映AD患者的代谢活性。
突触糖蛋白2是一种表达于突触囊泡中的蛋白。突触糖蛋白2示踪剂11C-UCB-J的初步研究表明,与对照组相比,癫痫患者颞叶和MCI和/或AD患者海马的结合减少。
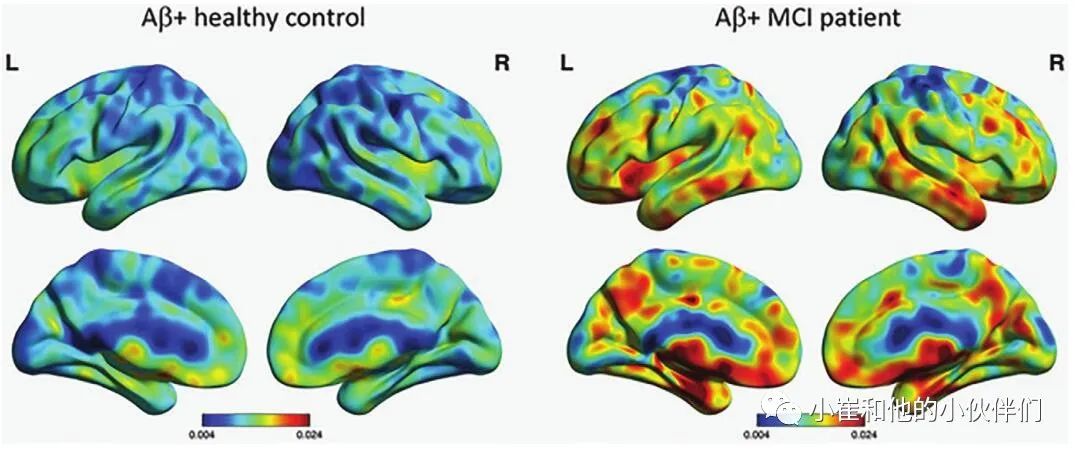
图8 星形胶质细胞激活的碳11C-DED PET表面投影图像
小 结
PET分子成像技术不仅可以帮助显示阿尔茨海默症的病理学特征,评估帕金森病中多巴胺能终末的丢失,而且新的神经炎症和突触密度示踪剂的发展进一步允许阐明阿尔茨海默病症的分子病理学特征。PET成像在痴呆症中的应用在过去十年中取得了重大进展,已经远远超越了使用非特异性代谢示踪剂(如FDG)来提供分子信息,从而在疑似神经退行性疾病患者的检查中提供了更大的病理特异性。
尽管有几种新的分子示踪剂可用于痴呆症患者的研究,但仍没有针对几个重要目标的成像示踪剂,例如对PD和DLB中a-synuclein聚集相关疾病的研究或额颞叶变性和运动神经元疾病的语义和行为变异相关的TAR DNA结合蛋白43。对于临床应用,一个重要的考虑因素是成像研究与那些评估生物液体(如脑脊液(CSF)或血浆中的生物标志物的成本。
虽然CSF便宜,不仅可以提供异常蛋白的标记物,还可以提供全谱分析物(葡萄糖、白蛋白、pH等)和其他神经炎症、神经元和/或突触完整性的特异性标记物,但它需要腰椎穿刺,许多人认为它具有侵入性。PET成像有助于提供更明确的证据,在脑内的整体和区域分子病理发现。但缺点是一次只能测量一个目标,而且昂贵得多,通常无法报销。因此,迫切需要对分子PET的影响进行实际研究。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







老年性痴呆,未来还是希望借助神经电生理吧,也许更为有效!
35