AlphaFold最新版——开启数字生物学时代来临! 预测几乎所有分子结构,带来药物研发新范式
2023-11-03 MedSci原创 MedSci原创 发表于威斯康星
大约五年前,DeepMind推出了AlphaFold,一个可以准确预测人体内许多蛋白质结构的人工智能系统,震惊全世界。后来很快又推出AlphaFold 2,进一步提高性能。2022年7月28日,Dee
大约五年前,DeepMind推出了AlphaFold,一个可以准确预测人体内许多蛋白质结构的人工智能系统,震惊全世界。后来很快又推出AlphaFold 2,进一步提高性能。2022年7月28日,DeepMind公司与欧洲生物信息研究所(EMBL-EBI)的合作团队公布了生物学领域的一项重大飞跃。他们利用人工智能(AI)系统AlphaFold预测出超过100万个物种的2.14亿个蛋白质结构,几乎涵盖了地球上所有已知蛋白质。这一突破将加速新药开发,并为基础科学带来全新革命。
2023年9月,瑞士巴塞尔大学的研究团队采用了略有不同的研究手段:他们创建了一个网络,连接了AlphaFold蛋白质结构数据库中超过5000万个预测最为准确的结构。随后,他们利用这些分组来识别蛋白质宇宙中最暗的一些角落。研究团队发现了全新的蛋白质形态。研究人员将其命名为“β花”(Beta-flower),因为其中包含了一些形态类似于花瓣的发夹状结构。研究发现,含有β花的蛋白彼此的亲缘关系较远,但其功能仍需进一步研究。此外,他们还向数据库中添加了多个蛋白家族,并证实了其中一个属于新的翻译靶向毒素-抗毒素系统超家族TumE-TumA。一项研究由首尔国立大学和苏黎世联邦理工学院的联合团队完成。在研究团队看来,以往的研究关注的往往是单一结构或具有相似结构的蛋白家族,而他们感兴趣的是绘制整个数据库中蛋白质之间的关联。为此,研究团队开发了一种名为Foldseek cluster的聚类算法,其可以根据蛋白质形态的相似性快速比较数据库中的每个结构,并对数以亿计的结构进行聚类分析。这两项研究均发表在2023年9月Nature杂志上。
但是,即使如此,有一些顶尖的结构生物学家仍然认为,他们的工作是AI无法触及的。今天的结构生物学家都要搞蛋白质间相互作用,以及蛋白质与RNA相互作用等全新的领域。
然而,这两天刚刚发布的最新版本的AlphaFold,给了人类一个响亮的耳光! 结构生物学家真的可以失业了。最新的AlphaFold可以对蛋白质数据库中的几乎所有分子生成预测,还能预测蛋白质相互作用,甚至还能预测DNA与RNA和蛋白质之间的相互作用。甚至还能扩展到任意小分子配体等其他的生物分子结构上,这,还有什么不可能???
AlphaFold最新进展——AlphaFold-latest,可能是AlphaFold 3的测试版或初版。也许AlphaFold 3才是那个震惊世界的人工智能!
新一代AlphaFold可以预测蛋白质数据库(PDB)中几乎任何分子的结构,通常具有原子精度,包括配体(小分子)、蛋白质、核酸(DNA 和 RNA)以及含有翻译后修饰 (PTM) 的生物分子。DeepMind称,新版模型扩展的功能和性能提升可以加速生物医学突破,为疾病通路、基因组学、生物可再生材料、植物免疫、潜在治疗靶点、药物设计机制提供各种全新的可能性。
一、AlphaFold推动数字生物学时代来临
AlphaFold-latest目前还是一个预览阶段,开发还没有完成,但在预测蛋白质结构之外的更广泛的任务中的表现出了惊人的性能。
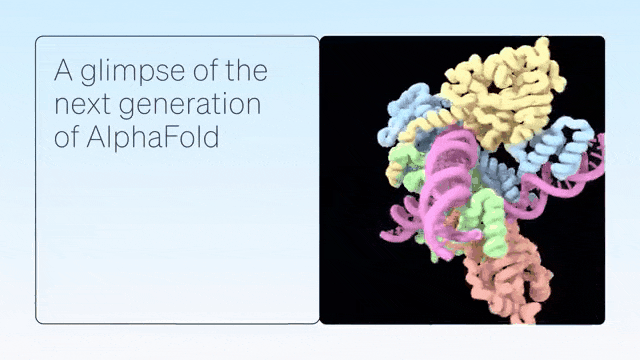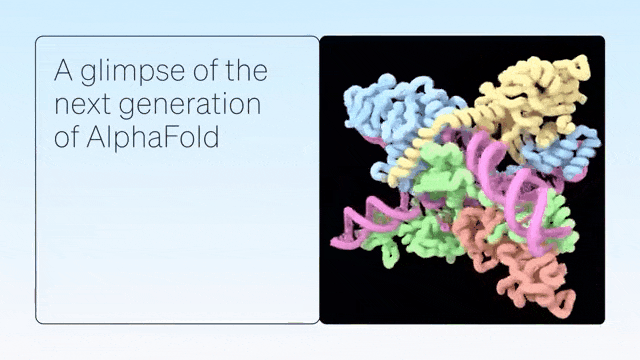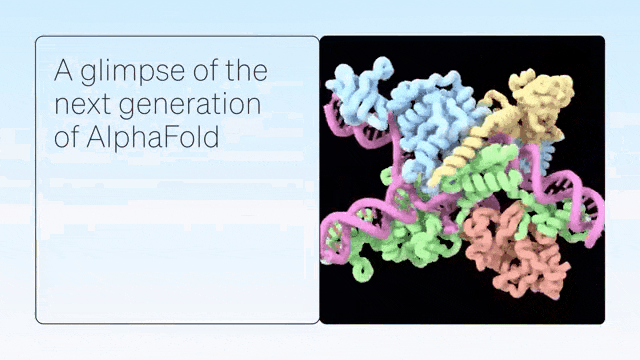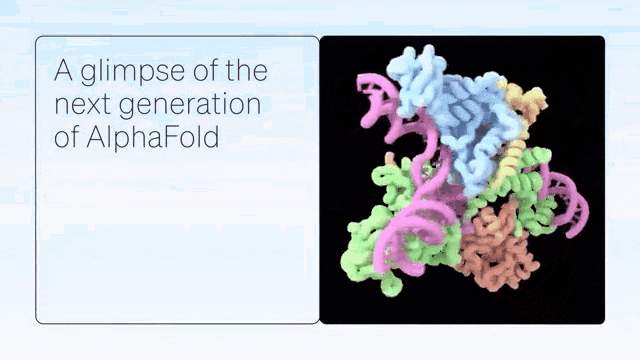
二、超越蛋白质折叠
AlphaFold是单链蛋白预测的根本性突破。紧接着,AlphaFold-Multimer扩展到具有多条蛋白质链的复合物,随后是 AlphaFold2.3,后者提高了性能并将覆盖范围扩大到更大的复合物。
2022 年,AlphaFold与EMBL的欧洲生物信息学研究所合作,通过AlphaFold蛋白质结构数据库免费提供几乎所有科学已知的编目蛋白质的结构预测。
迄今为止,已有190多个国家的4万用户访问了AlphaFold数据库,世界各地的科学家已经利用AlphaFold的预测来帮助推进各种研究。
DeepMind展示了 AlphaFold 在预测蛋白质折叠之外的准确结构方面的卓越能力,从而在配体、蛋白质、核酸和翻译后修饰方面生成高度准确的结构预测。
AlphaFold-latest是在2022年底的AlphaFold 2.3版本的基础上搭建的,对于蛋白质结构的预测,特别是结合了抗体结构的类别,有着更好的性能。对于构成核糖体等重要细胞组件的蛋白质-核酸复合物结构的预测,AlphaFold-latest优于RoseTTAFold2NA等同类模型。
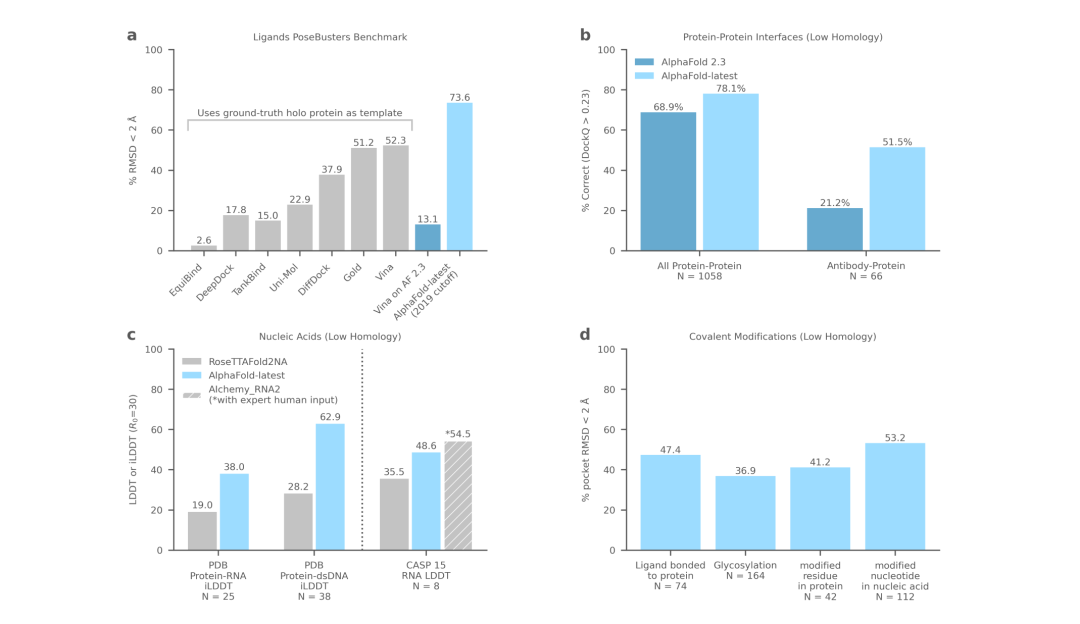
蛋白质-配体复合物 (a)、蛋白质 (b)、核酸 (c) 和共价修饰 (d) 的性能。
对于RNA结构的预测,也比其他模型表现好,不过相较于人类专家参与的预测性能,还有进一步提高的空间。对于人工智能的进化而言,这不是大的问题。
研究人员强调,AlphaFold并不是从头开始解决这些结构,而是从大量实验确定的结构中推断模式。
尽管如此,它适应新分子类别建模的灵活性凸显了支撑最近人工智能突破的泛化能力。
三、加速药物发现
准确预测蛋白质-配体结构是药物发现的一个非常有价值的工具,因为它可以帮助科学家识别和设计可能成为药物的新分子。目前的行业标准是使用“对接方法”来确定配体和蛋白质之间的相互作用。这些对接方法需要刚性参比蛋白结构和配体结合的建议位置。
DeepMind最新模型为蛋白质-配体结构预测设定了新的标准,在预测蛋白质-配体相互作用方面,新AlphaFold的性能比传统方法高出约20%,并且还可以预测尚未进行结构表征的全新蛋白质。AlphaFold-latest模型在一些与药物发现相关的蛋白质结构预测问题上大大优于AlphaFold2,例如抗体结合。它还可以联合模拟所有原子的位置,使其能够代表蛋白质和核酸在与其他分子相互作用时的全部固有灵活性, 这是使用对接方法无法实现的。
例如,在PORCN、KRAS、和PI5P4Kγ的验证中,AlphaFold最新模型的预测结构与实验确定的结构非常匹配:
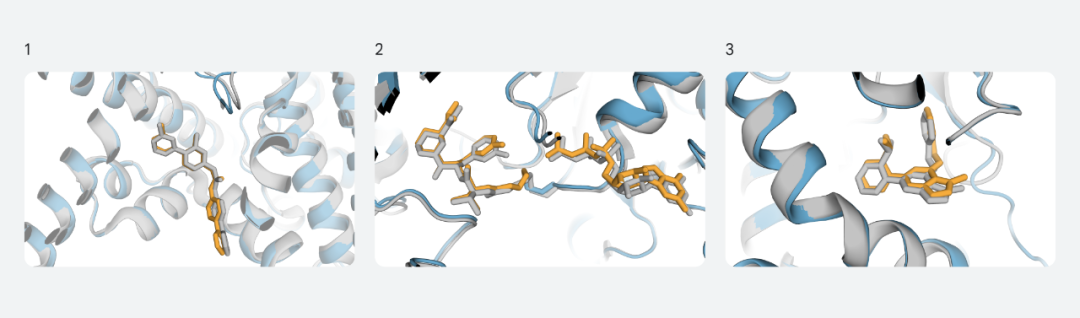
图:PORCN (1)、KRAS (2) 和 PI5P4Kγ (3) 的预测
Isomorphic Labs 正在将下一代 AlphaFold 模型应用于治疗药物设计,帮助快速准确地表征对治疗疾病很重要的多种类型的大分子结构。
四、对生物学的新认识,加速生物医药发展
通过解锁蛋白质和配体结构以及核酸和包含翻译后修饰的模型,新一代AlphaFold基础生物学提供了一种更快速、更准确的工具。
大家知道,目前的基因治疗关键的技术是AAV病毒载体和基因编辑,但是都面临一系列挑战。例如,如何提高AAV病毒的免疫逃逸能力,以免被人体免疫系统识别并清除?如何提高基因编辑的效率,减少脱靶效应。这些以前都需要大量的实验来解决。在未来,人工智能可能解决这一切问题!
例如,CasLambda具有CRISPR-Cas9系统的基因组编辑能力,研究人员可以用它来改变动物、植物和微生物的DNA。CasLambda较小的尺寸可以更有效地进行基因组的编辑。
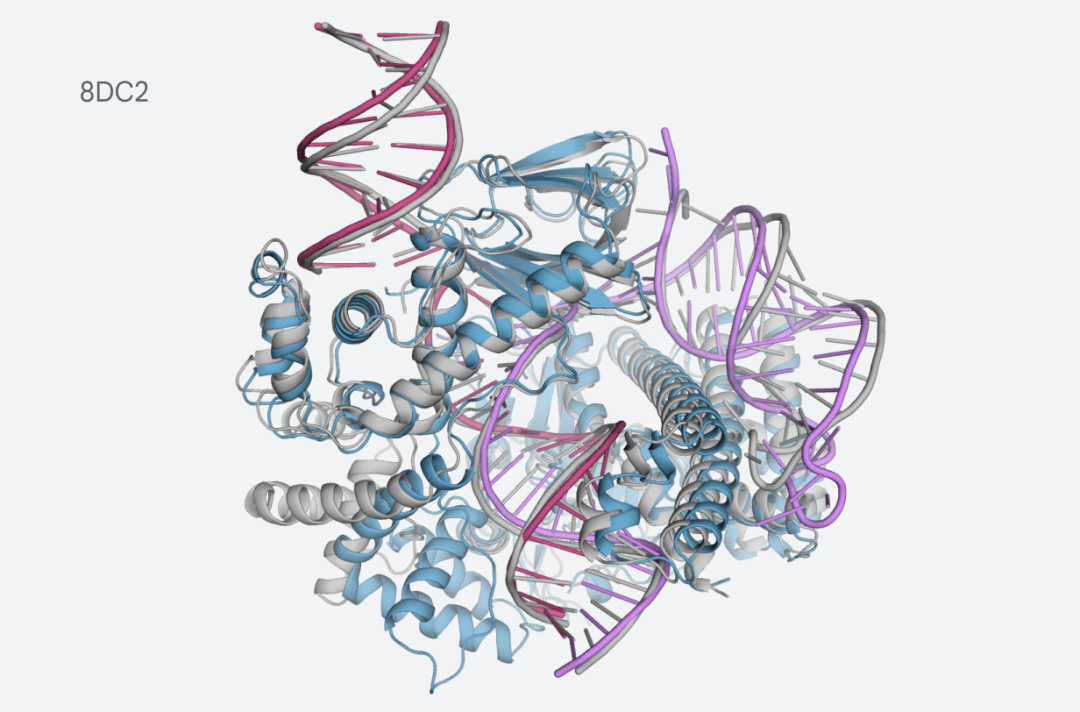
与crRNA和DNA结合的CasLambda的预测结构
最新版本的 AlphaFold 能够对此类复杂系统进行建模,这向我们表明人工智能可以帮助我们更好地理解这些类型的机制,并加速它们在治疗应用中的使用。
最新版本的AlphaFold能够模拟这些复杂的系统,展示了人工智能可以帮助更好地理解这些类型的机制,并加速它们在治疗应用中的应用。
五、推进科学探索,期待AlphaFold 3
AlphaFold在性能上的巨大提升,表明AI能够极大增强人类对构成人体的分子机制,以及更广泛的自然世界的科学理解。AlphaFold已经促进了世界各地的重大科学进步。
下一代AlphaFold能够使得人类以「数字化」的速度对生物医学领域进行科学探索。
AlphaFold 3的推出代表了分子建模和药物发现的巨大飞跃。凭借其预测复杂分子结构和相互作用的能力,它有望彻底改变制药市场。
https://www.isomorphiclabs.com/articles/a-glimpse-of-the-next-generation-of-alphafold
Barrio-Hernandez, I., Yeo, J., Jänes, J. et al. Clustering-predicted structures at the scale of the known protein universe. Nature (2023). https://doi.org/10.1038/s41586-023-06510-w
Durairaj, J., Waterhouse, A.M., Mets, T. et al. Uncovering new families and folds in the natural protein universe. Nature (2023). https://doi.org/10.1038/s41586-023-06622-3
‘A Pandora’s box’: map of protein-structure families delights scientists. from https://www.nature.com/articles/d41586-023-02892-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#AlphaFold#最新版——开启#数字生物学#时代来临! 预测几乎所有分子结构,带来#药物研发#新范式。#Deepmind#走的是另外一条#人工智能#道路,可能是最正确的,是带动了科学的发展。
51