Blood:分子学标志物有助于识别来那度胺维持治疗有获益的NDMM患者
2023-01-18 聊聊血液 聊聊血液 发表于安徽省
对于新诊断多发性骨髓瘤 (NDMM) 患者,来那度胺 (Len) 是目前标准的自体干细胞移植 (ASCT) 后维持治疗方案。
来那度胺维持治疗
对于新诊断多发性骨髓瘤 (NDMM) 患者,来那度胺 (Len) 是目前标准的自体干细胞移植 (ASCT) 后维持治疗方案。但来那度胺维持治疗也会伴随一些副作用,包括血细胞减少、血管事件、腹泻/胆汁酸吸收不良和继发性恶性肿瘤风险增加等。尽管来那度胺长期治疗的副作用在大多数患者中可控,但部分患者仍会面临连续治疗的生理和心理挑战,因此关于其对个体患者的获益可能存在问题。
在随机 III 期试验中,来那度胺维持治疗均可改善无进展生存期 (PFS),NCRI Myeloma XI (MyXI) 研究也证实可实现总生存期 (OS) 改善。然而临床试验和临床实践中患者间PFS 和 OS的异质性始终较大,导致估计个体患者从 Len 维持治疗中获益的概率并不简单。
为确定哪些患者可能从来那度胺维持治疗中获得最大获益,MyXI研究的研究者通过基因分析(包括共存的高危基因突变),探索了该研究中患者从维持治疗随机化开始计算的结局(来那度胺维持治疗vs.观察)。研究结果近日发表于《Blood》。
 研究方法
研究方法
NCRI Myeloma XI 3期研究中,适合移植的患者随机接受CTD、CRD或KCRD诱导治疗,并接受自体干细胞移植。ASCT后100天,合格患者进一步随机接受来那度胺、来那度胺+伏立诺他或观察。本分析联合分析了随机分配至来那度胺或来那度胺+伏立诺他组的患者。
作者对入组NCRI Myeloma XI研究并在 ASCT 后随机接受维持或观察的556例 NDMM 患者接受了扩展基因分析,包括拷贝数畸变 (CNA) del(1p)、del(17p)、gain(1q) 和不良易位t(4;14)、t(14;16)、t(14;20),及其共存情况:无打击(无不良突变;标危)、单打击(1个不良突变;高危)和双打击(≥2个不良突变;超高危)。
无进展生存期定义为从维持治疗随机化至 PFS 或后续进展 (PFS2)(根据 IMWG 标准)或全因死亡的时间。总生存期定义为从维持随机化日期至全因死亡的时间。
研究结果
556例患者存在扩展遗传数据,从维持治疗随机化开始的中位随访时间为51.6个月。个体基因突变的临床特征和频率见表1。
 同时存在≥2个突变较常见:在76例t(4;14) 中,47例 (62%) 至少存在双打击,56例 del(1p) 中的36例 (64%)、46例 del(17p) 中的26例 (57%) 和185例gain (1q) 中的83例 (45%) 也至少存在双打击(图1A)。双打击在t(14;16)/t(14;20) 中最常见,为70%,但t(14;16)/t(14;20) 并不常见(n= 20;3.6%)。因此单打击患者非常少,无法进行单独的统计分析。总体而言,32%的肿瘤表现为单打击,17%为双打击,51%无高危畸变(图1B)。这三个分子风险组之间的维持治疗前缓解率相当。
同时存在≥2个突变较常见:在76例t(4;14) 中,47例 (62%) 至少存在双打击,56例 del(1p) 中的36例 (64%)、46例 del(17p) 中的26例 (57%) 和185例gain (1q) 中的83例 (45%) 也至少存在双打击(图1A)。双打击在t(14;16)/t(14;20) 中最常见,为70%,但t(14;16)/t(14;20) 并不常见(n= 20;3.6%)。因此单打击患者非常少,无法进行单独的统计分析。总体而言,32%的肿瘤表现为单打击,17%为双打击,51%无高危畸变(图1B)。这三个分子风险组之间的维持治疗前缓解率相当。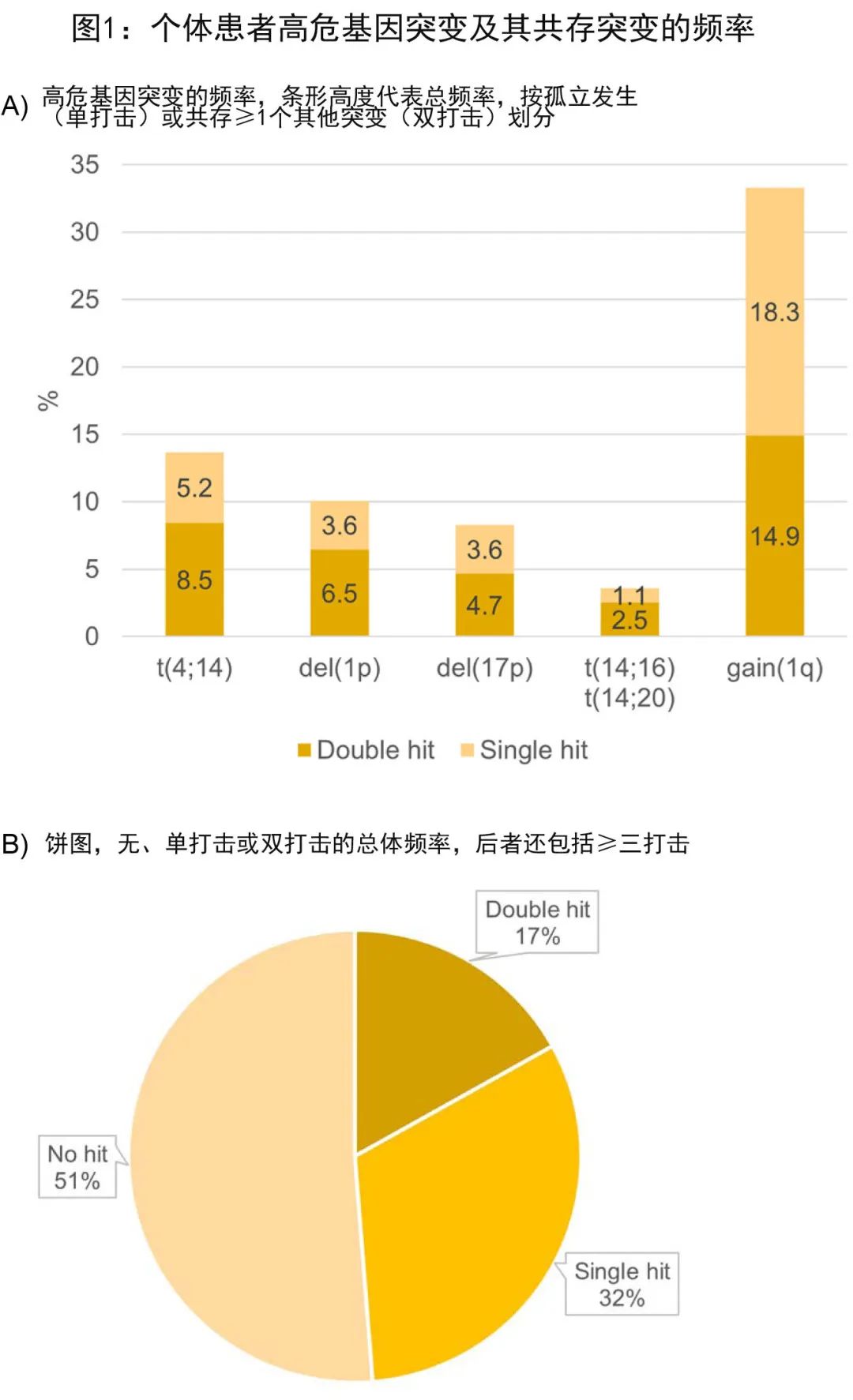 与观察组相比,来那度胺维持治疗的 PFS 更长 (HR= 0.50;P< 0.0001)、PFS2更长 (HR= 0.65;P= 0.002);OS 数值上较长但差异并不显著 (HR= 0.8;P= 0.17),很可能是由于该亚组分析中所包含的患者人数少于之前发表的满足显著性阈值的总体适合移植人群所致。来那度胺维持治疗组的中位 PFS 为53.8个月,观察组为27.3个月,中位 OS 分别为80.7个月和78.5个月。
与观察组相比,来那度胺维持治疗的 PFS 更长 (HR= 0.50;P< 0.0001)、PFS2更长 (HR= 0.65;P= 0.002);OS 数值上较长但差异并不显著 (HR= 0.8;P= 0.17),很可能是由于该亚组分析中所包含的患者人数少于之前发表的满足显著性阈值的总体适合移植人群所致。来那度胺维持治疗组的中位 PFS 为53.8个月,观察组为27.3个月,中位 OS 分别为80.7个月和78.5个月。
根据基因特征对患者进行分层后发现,来那度胺维持治疗对单打击患者的 PFS 获益最大 (HR= 0.38;P< 0.0001),其次是无打击患者 (HR= 0.46;P< 0.0001) 和双打击患者 (HR= 0.55;P= 0.017)。
作者进一步更详细地研究了单打击组,发现孤立性del(1p)、del(17p) 和t(4;14) 患者从来那度胺维持治疗中获益更多,PFS的 HR 分别为0.02(p= 0.0012)、0.1(p= 0.0095) 和0.14(p= 0.0009)(图2)。随机分配至观察组的孤立性 del(1p) 或t(4;14) 患者在 ASCT 后出现极早期复发,自随机化起的中位 PFS 分别为7.5个月和9.9个月(图2);而随机分配至来那度胺维持治疗组的 del(1p) 或t(4;14) 患者的中位 PFS 与整个组无差异,分别为57.6个月和54.3个月。此外对于del(17p),观察组患者的中位 PFS 为26.7个月,而来那度胺维持组为50.5个月。
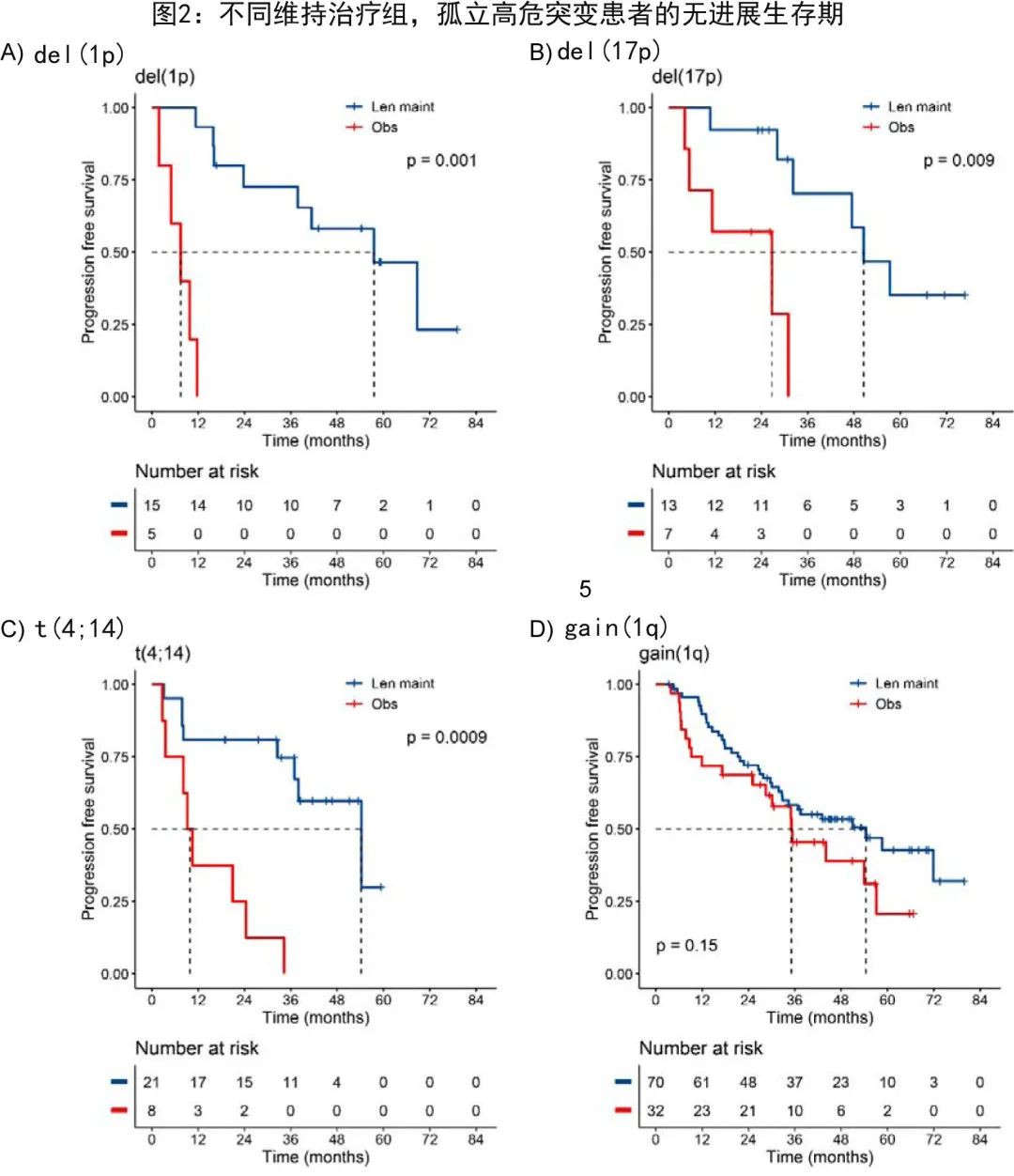 由于组样本量较小,作者联合分析了del(1p)、del(17p) 和t(4;14) 组的PFS2 和 OS,结果来那度胺维持治疗组的中位 PFS2 长于观察组,分别为60.5和29.7个月(HR= 0.27;P= 0.0002),中位 OS 也较长,分别为未达到和70.8个月(HR= 0.41;P= 0.032)(图3)。相比之下,对于无高危病变患者,来那度胺维持治疗组中位PFS2未达到,而观察组为78.5个月(HR= 0.56;P= 0.01),中位 OS 为未达到和82.4个月(HR= 0.69;P= 0.2)。
由于组样本量较小,作者联合分析了del(1p)、del(17p) 和t(4;14) 组的PFS2 和 OS,结果来那度胺维持治疗组的中位 PFS2 长于观察组,分别为60.5和29.7个月(HR= 0.27;P= 0.0002),中位 OS 也较长,分别为未达到和70.8个月(HR= 0.41;P= 0.032)(图3)。相比之下,对于无高危病变患者,来那度胺维持治疗组中位PFS2未达到,而观察组为78.5个月(HR= 0.56;P= 0.01),中位 OS 为未达到和82.4个月(HR= 0.69;P= 0.2)。
 与观察组相比,来那度胺维持组gain (1q) 单打击患者的PFS (HR= 1.5;P= 0.2) 或OS (HR= 1.1;P= 0.9) 均未显著改善(图2)。然而观察组gain(1q) 患者在 ASCT 后未早期复发,中位 PFS 为35.1个月vs 54.4个月(来那度胺维持治疗),这与 del(1p) 或t(4;14) 患者不同。此外分析与 1q 拷贝数相关的结局发现,比较 1q 拷贝数为3或≥4个(amp(1q)) 拷贝数时,来那度胺维持组与观察组的结局无差异。
与观察组相比,来那度胺维持组gain (1q) 单打击患者的PFS (HR= 1.5;P= 0.2) 或OS (HR= 1.1;P= 0.9) 均未显著改善(图2)。然而观察组gain(1q) 患者在 ASCT 后未早期复发,中位 PFS 为35.1个月vs 54.4个月(来那度胺维持治疗),这与 del(1p) 或t(4;14) 患者不同。此外分析与 1q 拷贝数相关的结局发现,比较 1q 拷贝数为3或≥4个(amp(1q)) 拷贝数时,来那度胺维持组与观察组的结局无差异。
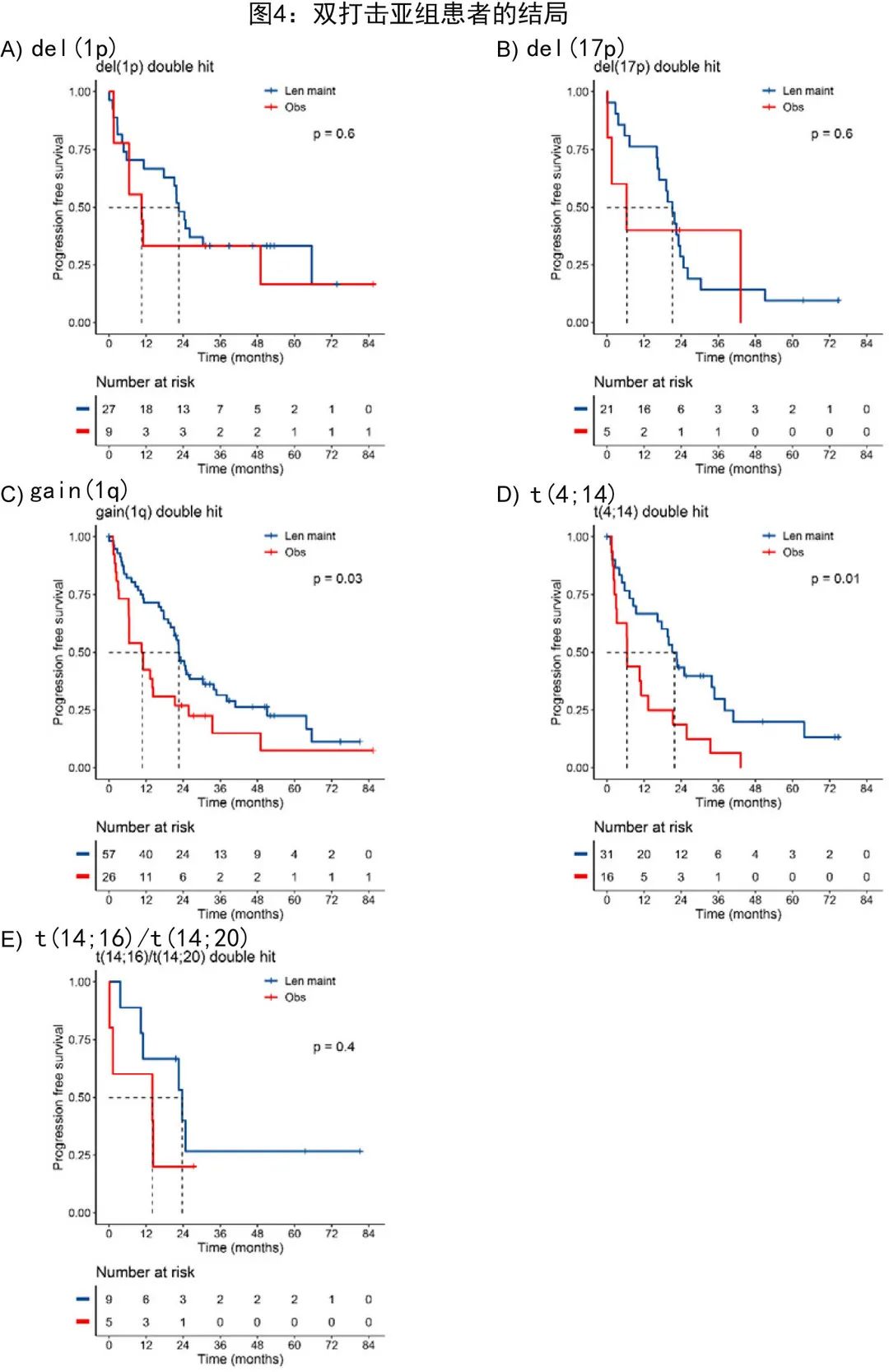
尽管双打击患者数值上可从来那度胺维持治疗中获益,但这类患者的结局通常最差,来那度胺维持治疗组的中位 PFS 为22.5个月,观察组为10.6个月(HR= 0.55;P= 0.02),中位 OS为47.3 vs. 32.8个月(HR= 0.88;P= 0.7)。为了研究双打击患者的结局是否存在差异,作者进行了遗传亚组分析,其中相应亚组中的所有患者均携带gain(1q)、del(1p)、del(17p)、t(4;14) 或t(14;16)/t(14;20),结果所有双打击患者亚组的中位 PFS 均小于24个月,即使是来那度胺维持组的患者(图4)。
 结论
结论
总的来说,本研究结果强烈支持在 ASCT 后给予来那度胺维持治疗,用于伴孤立性风险标志物del(1p)、del(17p) 或t(4;14) 的 NDMM 患者,该治疗与 PFS 和 OS 显著延长相关;而孤立性gain(1q) 患者的获益有限。为了确定有获益的患者,以及需要新维持方案的双打击患者,应考虑对所有适合移植的 NDMM 患者进行诊断时的扩展分析,最低要求为t(4;14)、t(14;16)/t(14;20)、del(1p)、gain(1q) 和 del(17p) 评估。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






