一例初始不可切除食管癌经新辅助免疫治疗后转化成功病例分享
2024-05-13 网络 网络 发表于上海
本期将分享一例初始不可切除食管癌患者接受新辅助免疫联合化疗,治疗3周期后肿瘤获得明显退缩,术后病理达到pCR的病例。希望可为临床不可手术切除的食管癌临床治疗带来更多启示。
对于可切除的食管癌患者,术前给予新辅助治疗是临床上常用的一种治疗模式,也获得了国内外多个指南的推荐。随着肿瘤免疫治疗时代的到来,在新辅助化疗的基础上加入免疫检查点抑制剂已成为行之有效的治疗策略1-2。近年来,免疫治疗药物也开启了在不可切除局部晚期食管癌的转化治疗领域的积极探索。本期将分享一例初始不可切除食管癌患者接受新辅助免疫联合化疗,治疗3周期后肿瘤获得明显退缩,术后病理达到pCR的病例。希望可为临床不可手术切除的食管癌临床治疗带来更多启示。
病例介绍
一、基本情况
患者男性,66岁,因“进行性吞咽困难3月余”于2023-07-19入院,查体无明显阳性体征。既往史,家族史,疾病史均无殊。
二、辅助检查与诊断
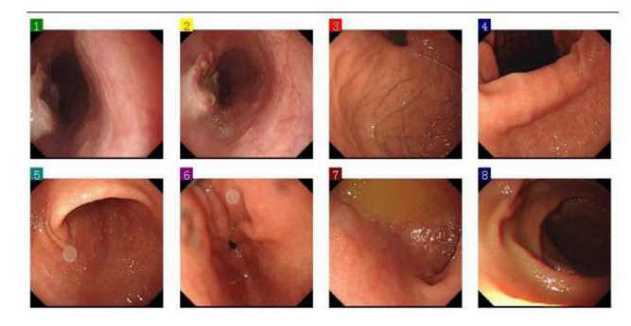
1.胃镜检查(2023-07-17)
检查所见:检查前即刻口服利多卡因胶浆10ml,无不良反应。食管距门齿35-37cm可见不规则隆起,中央凹陷覆白苔,大小约2.0*2.0cm,活检2块送病理加快。贲门松弛。胃底、胃体粘膜光整,色泽正常,未见肿物与溃疡,胃角、胃窦部粘膜呈斑片状充血、花斑样改变,幽门圆,开放好,十二指肠球部及所见降部未见明显异常。进镜过程顺利,操作过程顺利,术中无并发症出现。
诊断:食管Ca考虑;食管裂孔疝;慢性胃炎(木村-竹本分型C2)Hp既往感染考虑。

2023-07-17胃镜检查
2.病理检查(2023-07-18)
镜下形态:

病理诊断:(距门齿36cm)活检,低分化鳞状细胞癌。
3.胸部CT(2023-07-13):
检查所见:食管下段壁增厚,增强后轻度强化。平扫肺窗显示两肺野透亮度不均,可见多发大小不等透亮影,局部呈马赛克样改变;两肺散在索条状、斑片状高密度灶,边界清晰。增强后纵隔窗显示两肺门无增大,气管支气管通畅,血管及脂肪间隙清晰,纵隔未见肿大淋巴结。
诊断结果:
两侧慢性支气管病变、肺气肿。
两肺散在纤维增殖灶。
两侧胸膜增厚。
食管下段壁增厚伴强化,符合癌影像学表现。


2023-07胸部CT检查病灶情况:食管下段肿物,临近大血管,初始不可切除,食管管腔几乎不可见
(蓝色箭头)
4.全腹增强CT(2023-07)
检查所见:肝脏包膜光滑,各肝叶比例无异常。肝VI、VII段动脉期强化结节,静脉期强化持续,延迟期呈等密度,另肝内多发类圆形低密度无强化灶,较大者位于肝IVb段,长径约11m。肝内外胆管无扩张。胆囊形态不大,胆囊壁毛糙,多发强化细小结节。脾脏形态及密度未见异常,脾周结节,强化方式同脾脏一致。胰腺形态如常,实质密度均匀,周围间隙清,胰管稍扩张。双肾位置形态无殊,密度均匀,双侧肾盂、输尿管未见明显扩张积水征象。后腹膜未见明显肿大淋巴结。附见:食管下段局部管壁增厚、强化。
诊断结果:
肝IVI、VII段动脉期、静脉期强化结节,A -P分流首先考虑,随访。
肝内多发囊肿;胆囊多发小息肉;胰管稍扩张。
副脾。
5.头颅磁共振(2023-07)
检查所见:两侧脑室旁、两侧额顶叶白质及半卵圆区见多发点片状长T2信号,FLAIR呈高信号,脑室、脑池、脑沟未见明显异常,中线结构在位。DWI未见明显弥散受限征象。附见:右侧上颌窦粘膜下囊肿。
诊断结果:
两侧脑室旁、两侧额顶叶白质及半卵圆区多发腔隙灶。
三、治疗经过
1.新辅助免疫治疗:
患者身高1.65m,体重65kg,排除化疗禁忌后于2023-07-19开始行免疫+化疗,方案:白蛋白紫杉醇200mg D1 D8+卡铂450mg+斯鲁利单抗300mg。
第一次用药后疗效评估:
胸部CT(2023-07-29)
检查所见:食管下段壁增厚,增强后轻度强化。平扫肺窗显示两肺野透亮度不均,可见多发大小不等透亮影,局部呈马赛克样改变;两肺散在索条状、斑片状高密度灶,边界清晰。纵隔窗显示两肺门无增大,气管支气管通畅,血管及脂肪间隙清晰,纵隔多发小淋巴结。附见:肝内多发囊肿。
诊断结果:
食管癌化疗后复查,较前2023-07-13好转,建议复查。
两侧慢性支气管病变、肺气肿。
两肺散在纤维增殖灶,较前相仿。
两侧胸膜增厚。

2023-07-29胸部CT:肿瘤较前明显缩小,管腔逐渐可见(蓝色箭头)
患者初次治疗后感觉良好,对效果满意。于2023-08-14继续白蛋白紫杉醇200mg D1 D8+卡铂450mg+斯鲁利单抗300mg方案治疗。第二次用药后疗效评估:胸部CT(2023-08-25)可见肿瘤较初始明显缩小,食管管腔清晰可见。故患者要求继续原方案治疗。
第三次用药后疗效评估:
胸部CT(2023-09)
检查所见:食管癌化疗后复查,食管下段壁稍增厚、毛糙,增强后轻度强化,平扫肺窗显示两肺野透亮度不均,可见多发大小不等透亮影,局部呈马赛克样改变;两肺散在索条状、斑片状高密度灶,边界清晰。纵隔窗显示两肺门无增大,气管支气管通畅,血管及脂肪间隙清晰,纵隔多发小淋巴结。两侧胸膜增厚。附见:肝内多发囊肿。
诊断结果:食管癌治疗后复查,较前2023-08-25食管下段病变部分缩小,请结合临床随诊。两侧慢性支气管病变、肺气肿、散在纤维增殖灶。两侧胸膜增厚。

胸部CT(2023-09):肿瘤较前明显缩小,管腔逐渐可见(蓝色箭头)
患者治疗过程中肿瘤标志物癌胚抗原(CEA)的变化:

2. 手术治疗:
排除手术禁忌症后,患者于2023-10-07行外科手术治疗。术后病理提示肿瘤完全缓解(pCR),PD-L1 CPS评分为50。
术后病理:

病理诊断:
(食管+残胃),新辅助治疗后,未见明确肿瘤残留
肿瘤数目及大小:1灶,原瘤床大小2.5*1.5cm
组织学类型:黏膜下层见淋巴细胞聚集,小血管及少量纤组织增生,未见明确肿瘤残留
淋巴结/血管侵犯:脉管内未见癌栓(HE)
神经周侵犯:未见
壁内转移:未见
切缘:上、下及环周切缘均阴性
pTNM分期(AJCC第8版):ypT0N0Mx
术前治疗疗效评估(AJCC第8版):TRG0(完全反应)
3.后续治疗及随访
患者术后可,2023-11-20继续行白蛋白紫杉醇 200mg D1 D8+卡铂 450mg+斯鲁利单抗 300mg治疗,随后于2023-12开始斯鲁利 300mg 免疫单药维持至今,未见肿瘤明显复发。
讨论
国际癌症研究机构(IARC)于2020年发布的全球癌症数据统计显示,我国是食管癌高发国,发病率为13.8/10万,死亡率为12.7/10万,发病率及死亡率分别位列所有癌症的第六位和第四位3-4。此外,我国一项多中心、观察性研究显示,近半数食管癌确诊时已处于III/IV期5。这表明,食管癌是严重影响我国人民群众的主要癌症负担之一。尽管多年来我国癌症防控工作适度地降低了食管癌的发病率,抗肿瘤手段的丰富也进一步提高了总体生存率,然而受到我国庞大人口基数及老龄化进程加剧,我国食管癌诊疗依然面临着严峻考验1。
对于经外科评估可切除的局部进展期食管癌,新辅助免疫治疗已在部分临床研究中显示出安全性和初步疗效6-9,但在不可切除的局部晚期食管癌中,新辅助免疫治疗在转化治疗中的作用知之甚少。
本案例患者在完成3个周期的新辅助免疫联合化疗治疗(斯鲁利单抗联合化疗)后,肿瘤较前明显缩小,食管管腔逐渐可见,且CEA实现了稳定下降,后患者在接受R0根治术后,病理提示ypT0N0Mx,治疗效果为pCR。结果提示,以斯鲁利单抗为基础的联合治疗方案治疗不可切除食管癌的转化治疗效果显著,这表明斯鲁利单抗在新辅助治疗中可发挥积极作用。期待未来,斯鲁利单抗为不可切除、围术期食管癌的治疗提供更多依据,给更多食管癌患者带来获益。
目前,斯鲁利单抗已在ASTRUM-007研究中被证实,联合化疗一线治疗晚期食管癌患者,可显著延长患者的总生存期(OS)和无进展生存期(OS),尤其在PD-L1 CPS≥10人群中,OS长达18.6个月,较单纯化疗约长5个月(单纯化疗组OS为13.9个月,HR=0.59[0.40-0.88])。此外,在客观缓解率和缓解持续时间方面,斯鲁利单抗联合化疗都展示出明显优势,其抗肿瘤活性更强,同时安全性良好10。目前,斯鲁利单抗已于2023年9月22日正式获得中国国家药品监督管理局(NMPA)批准上市,用于联合化疗一线治疗局部晚期/转移性食管鳞癌(ESCC)患者,这给晚期食管癌患者带来了免疫治疗新手段11。
尽管现阶段免疫治疗方案是否适合用于术前新辅助治疗模式尚缺乏高级别循证医学证据,指南推荐在临床研究范畴内患者充分知情同意后开展1。但随着免疫治疗在食管癌中的探索,相信未来会有更多高级别循证医学证据为免疫治疗在不可切除食管癌的转化治疗中提供支持。同时,通过对治疗方案的不断探索、实践,以及对新理念和新技术的应用和推广,免疫治疗将从晚期到局部晚期再到围术期,为中国食管癌患者带来全程获益。
专家简介

蔡文
浙江大学医学院附属第二医院肿瘤内科 主治医师 医学博士
2023年 CSCO全国消化道肿瘤病例越野赛冠军
2023年 CSCO 35 under 35 全国百强
主持并参与多项国家及省级基金课题;以第一及共同一作者发表SCI论文10余篇;参加ENETS、ESMO、JSMO、CSCO等国内外肿瘤学会议并报告研究成果
学术兼职:
●中国抗癌协会青年理事会会员
●中国临床肿瘤学会 CSCO 会员
●中国抗癌协会大肠癌专业委员会 会员
●中国胰腺病学会 会员 中国抗癌协会肿瘤心理学专业委员会 会员
参考文献:
1. 国家癌症中心,中国医师协会胸外科医师分会,中华医学会胸心血管外科学分会,等. 中国可切除食管癌围手术期诊疗实践指南(2023版).中华医学杂志,2023,103(33) : 2552-2570.
2. Obermannová R, Alsina M, Cervantes A, et al. Oesophageal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022;33(10):992-1004.
3. https://gco.iarc.fr/today/data/factsheets/cancers/6-Oesophagus-fact-sheet.pdf
4.https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf
5. Zeng H, Ran X, An L, et al. Disparities in stage at diagnosis for five common cancers in China: a multicentre, hospital-based, observational study. Lancet Public Health. 2021;6(12):e877-e887.
6.Ge F, Huo Z, Cai X, et al. Evaluation of Clinical and Safety Outcomes of Neoadjuvant Immunotherapy Combined With Chemotherapy for Patients With Resectable Esophageal Cancer: A Systematic Review and Meta-analysis. JAMA Netw Open. 2022;5(11):e2239778.
7. Xu L, Wei XF, Li CJ, et al. Pathologic responses and surgical outcomes after neoadjuvant immunochemotherapy versus neoadjuvant chemoradiotherapy in patients with locally advanced esophageal squamous cell carcinoma. Front Immunol. 2022;13:1052542.
8. Zhu J, Leng X, Gao B, et al. Efficacy and safety of neoadjuvant immunotherapy in resectable esophageal or gastroesophageal junction carcinoma: A pooled analysis of prospective clinical trials. Front Immunol. 2022;13:1041233.
9. Yang Y, Tan L, Hu J, et al. Safety and efficacy of neoadjuvant treatment with immune checkpoint inhibitors in esophageal cancer: real-world multicenter retrospective study in China. Dis Esophagus. 2022;35(11):doac031.
10. Song Y, Zhang B, Xin D, et al. First-line serplulimab or placebo plus chemotherapy in PD-L1-positive esophageal squamous cell carcinoma: a randomized, double-blind phase 3 trial. Nat Med. 2023;29(2):473-482.
11. https://www.nmpa.gov.cn/
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言