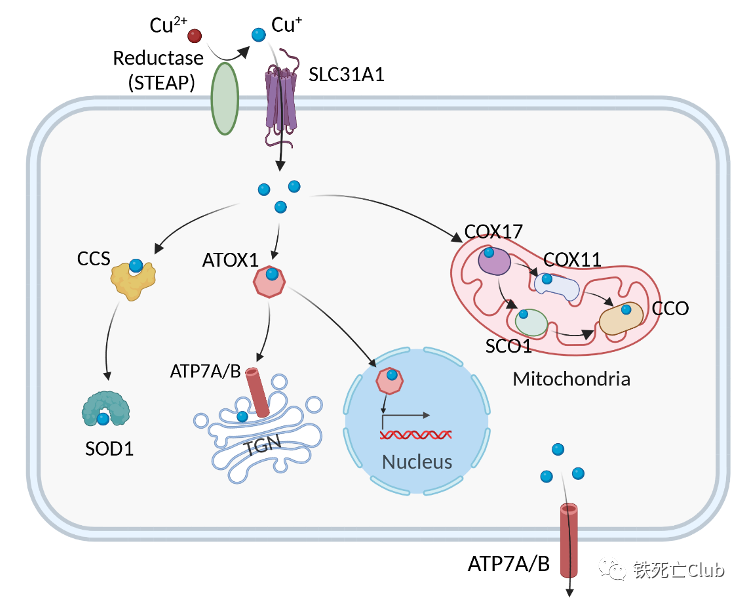
胡志军/李仁宏/代家勇ACS Nano:负载铜离子的纳米异质结通过氧化应激和诱导细胞铜死亡实现原位骨肿瘤的高效治疗
2023-11-01 BioMed科技 BioMed科技 发表于上海
本研究为基于二维纳米材料和实现安全高效的恶性疾病治疗提供了新思路。
恶性骨肿瘤是一类高度异质性的疾病,病程进展迅速且临床治疗效果欠佳。大多数病例发生在10至30岁的儿童和青年人群中,发病高峰在青春发育期,虽然局部骨肉瘤患者的5年生存率已提高至60%左右,但发生转移和复发的骨肉瘤病人生存率仅为20%。因此,开发安全高效的新方式用于恶性骨肿瘤治疗,并抑制骨肿瘤转移的发生,是科学研究的前沿课题。纳米催化治疗,是指纳米催化药物响应外部刺激(如光,声,力等)或利用肿瘤细胞与正常细胞的代谢途径不同而产生的特征性生化条件(如微酸性环境和内源性过表达的过氧化氢),催化产生大量细胞毒性的活性氧物质(单线态氧,羟自由基,超氧阴离子),诱导肿瘤细胞凋亡的治疗方式。由于肿瘤细胞具有较低氧化应激阈值,更易受到ROS介导的损伤,且ROS寿命较短,不会在体内大量蓄积,且催化反应的发生受到外界刺激和组织微环境的约束,可将催化治疗限制在特定部位,最大限度地避免对正常组织的损伤,因此,纳米催化治疗是十分理想的恶性骨肿瘤治疗新方式。
基于此,浙江大学医学院附属邵逸夫医院胡志军/代家勇课题组联合浙江理工大学李仁宏教授课题组,在前期研究的基础上(ACS Appl Mater Interfaces 2019, 11, 10589;Chem Eng J 2021, 421, 129773;Carbon 2023, 204, 196.),设计制备了一种新型纳米催化药物。作者首先通过分步煅烧和超声剥离制备了具有donor-acceptor(三嗪-七嗪)结构的面内异质性氮化碳纳米片(HCN),其次在水热反应和超声剥离后的金属相二硫化钼纳米片表面负载铜离子(CuMS),最后利用HCN和CuMS构建了范德华异质结(HCN@CuMS),并用cRDG-PEG-DSPE对纳米催化药物HCN@CuMS进行肿瘤靶向性修饰。实验数据表明,异质结形成和铜离子掺杂显著提高了纳米催化药物响应近红外光催化产生ROS的性质,且二硫化钼表面吸附的铜离子大量以一价铜的形式存在,巧妙整合了化学催化治疗和Cu+诱导细胞铜死亡的性质,省却了Cu2+还原成Cu+的过程,极大地提高了治疗效率。将T-HCN@CuMS用于原位骨肿瘤治疗,可显著抑制原位肿瘤的生长和骨肿瘤肺转移的发生。该研究以“Copper-Loaded Nanoheterojunction Enables Superb Orthotopic Osteosarcoma Therapy via Oxidative Stress and Cell Cuproptosis”为题发表于ACS Nano(IF:17.1)杂志,课题组夏杰超、胡川、吉音文为论文共同第一作者。
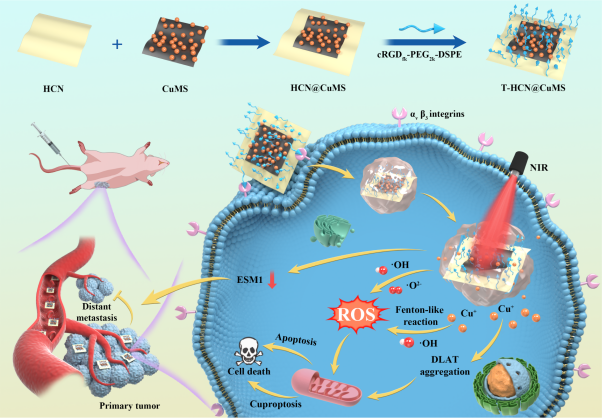
Scheme 1. T-HCN@CuMS纳米催化药物的制备及其潜在抗肿瘤和抗转移机制示意图。
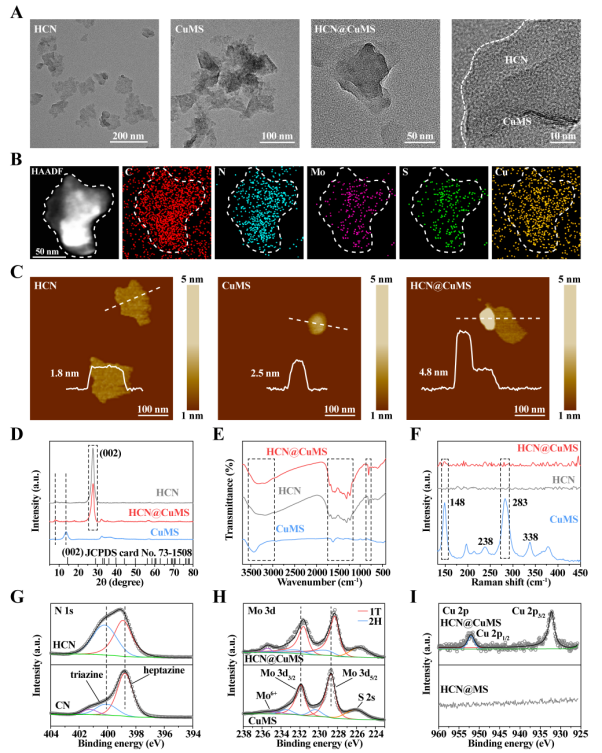
图1. HCN@CuMS的形貌和结构表征。
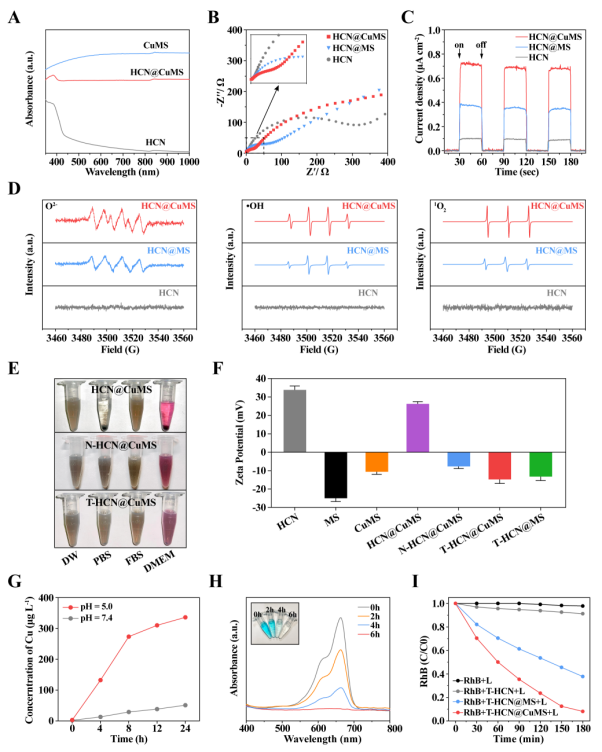
图2. HCN@CuMS的催化性质表征。
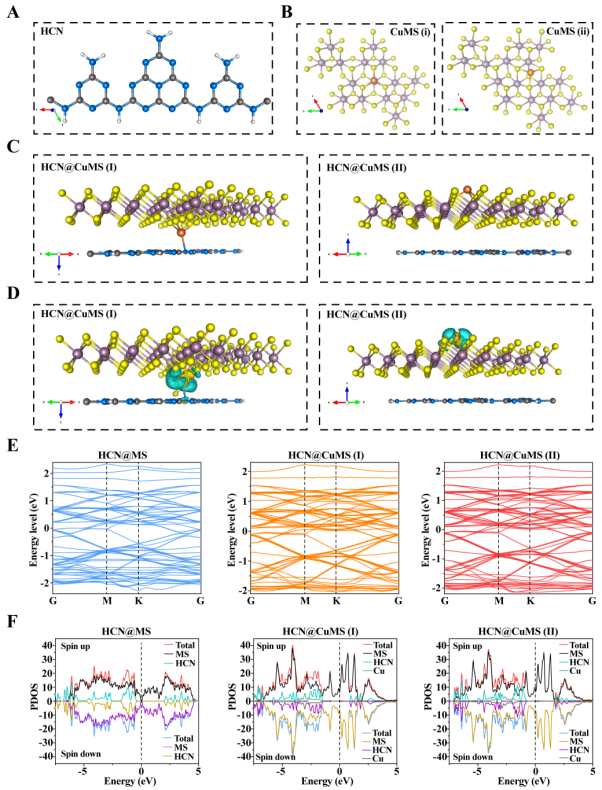
图3. HCN@CuMS催化性能的DFT理论计算。
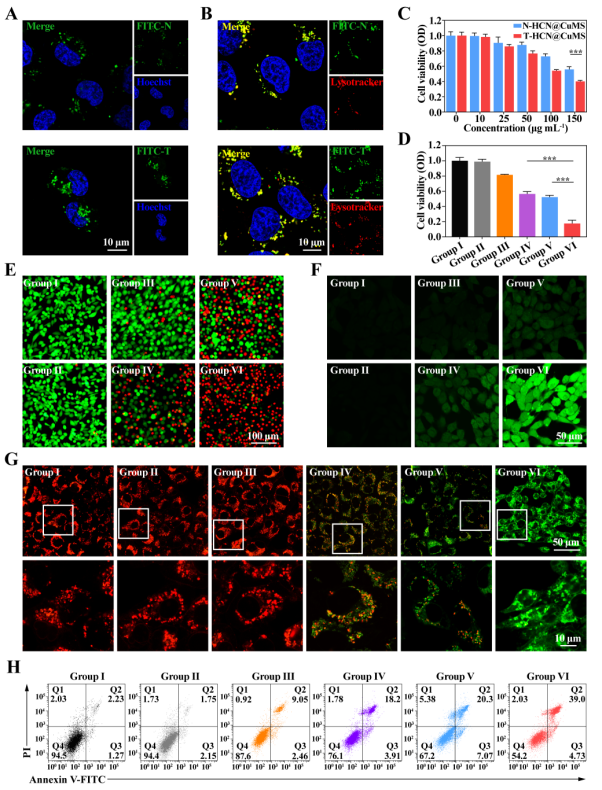
图4. T-HCN@CuMS抗肿瘤功能的体外评价。
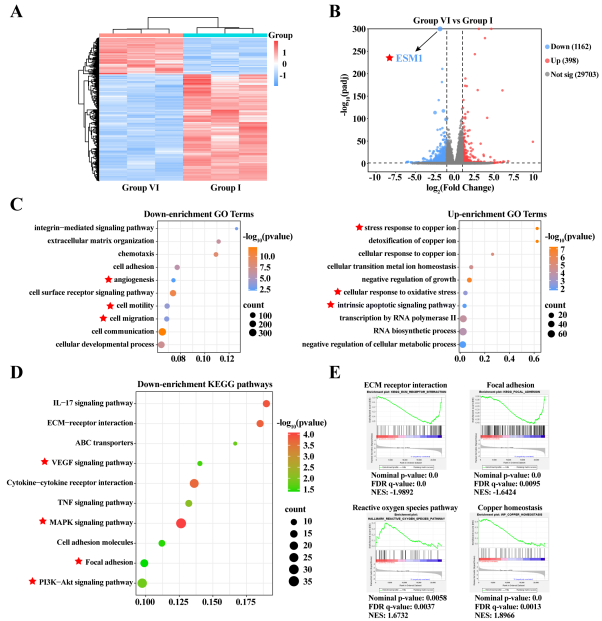
图5. 转录组学测序分析。
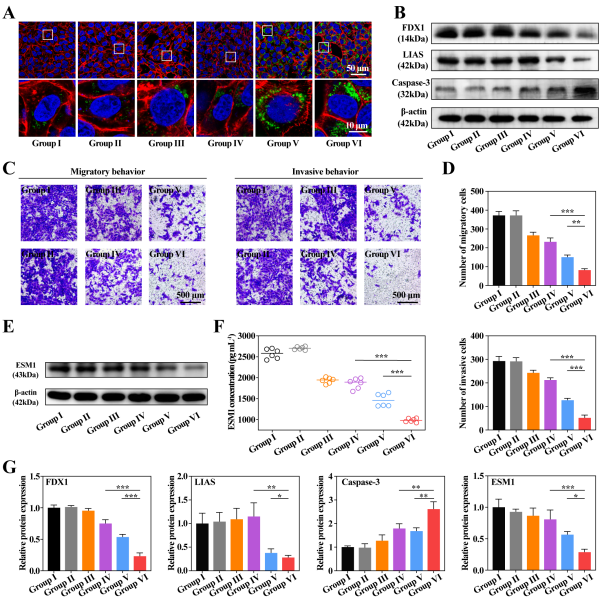
图6. T-HCN@CuMS抗肿瘤和抗转移机制探究。
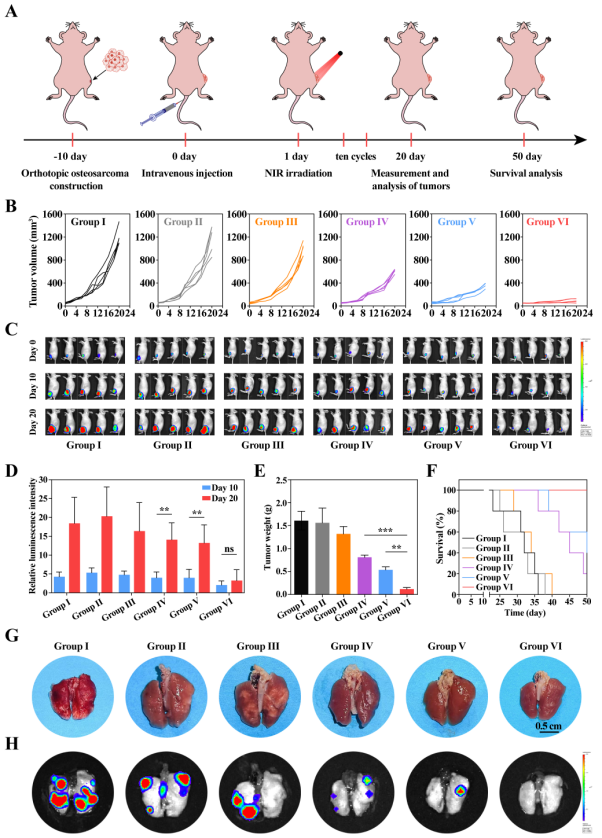
图7. 利用原位骨肉瘤模型考察T-HCN@CuMS体内抗肿瘤和抗转移性能。
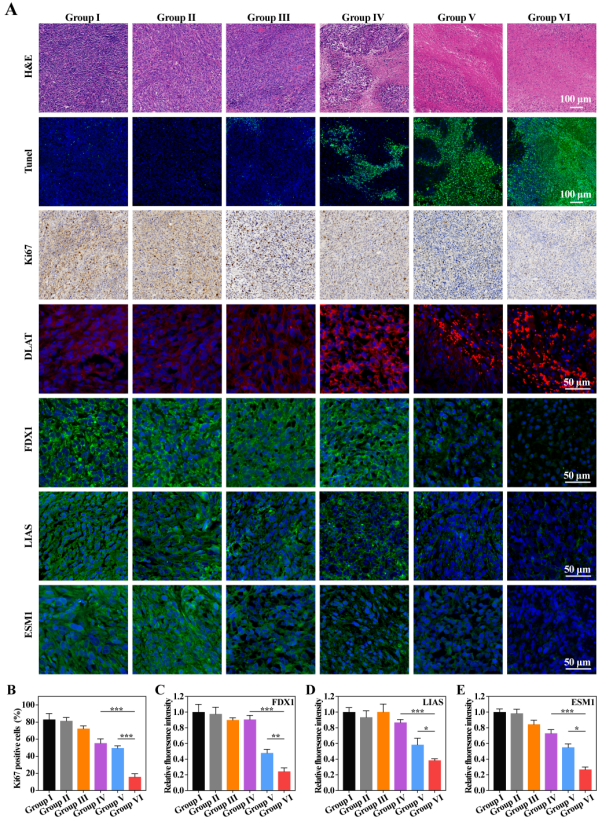
图8. T-HCN@CuMS体内抗肿瘤和抗转移机制验证。
本研究中设计制备了一种集靶向性、多功能、制备简便、生物安全等于一体新型纳米催化药物T-HCN@CuMS,在体外和高转移性原位骨肉瘤模型中均取得了令人满意的抗肿瘤和抗转移效果,为基于二维纳米材料和实现安全高效的恶性疾病治疗提供了新思路。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c04903
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言