J Clin Oncol:Ciltacabtagene autoleucel在我国复发或难治性多发性骨髓瘤成人患者中的疗效
2022-10-22 MedSci原创 MedSci原创
单次输注Cilta-cel可使既往多次治疗过的复发或难治性多发性骨髓瘤中国患者获得早期的、深程度的、持久的缓解
Ciltacabtagene autoleucel(Cilta-cel)是一种靶向B细胞成熟抗原(BCMA)的自体嵌合抗原受体(CAR)T细胞疗法,是使用患者自己的T细胞定制的,这些T细胞被收集和基因改造,然后输回患者体内。
2022年2月28日,美国FDA批准Cilta-cel用于治疗接受过≥4线治疗(包括蛋白酶体抑制剂[PI]、免疫调节剂[IMiD]和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤(RRMM)成人患者。
CARTIFAN-1研究旨在评估Cilta-cel在中国复发/难治性多发性骨髓瘤患者中的疗效和安全性。
这是一项我国开展的开放标签的II期飞行试验,招募了接受过≥3线治疗的RRMM成人患者。予以单剂Cilta-cel输注(靶剂量 0.75x106嵌合抗原受体阳性T细胞/kg)。主要终点是总缓解率。次要终点包括无进展生存期(PFS)、总生存期(OS)和不良事件的发生率及严重程度。
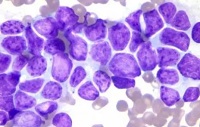
截止2021年7月19日,共48位患者接受了Cilta-cel输注。中位随访了18个月后,总缓解率是89.6%(95% CI 77.3-96.5),首次缓解前的中位时间大约是1个月;77.1%的患者获得了完全缓解或更好缓解。中位缓解持续时间、PFS和OS均未达到。18个月PFS率和OS率分别是66.8%和78.7%。
常见血液性不良事件,包括贫血(100%)、中性粒细胞减少症(97.9%)、淋巴细胞减少(95.8%)和血小板减少(87.5%)。97.9%的患者发生了细胞因子释放综合征(35.4%的病例是3-4级),发作前的中位时间是7天,中位持续时间是5天。85.4%的患者发生过感染(37.5%的3-4级)。10位患者死于Cilta-cel输注之后,其中8例与治疗相关不良事件有关。
总之,该研究结果显示了单次输注Cilta-cel的有利风险-获益谱,可使既往多次治疗过的复发或难治性多发性骨髓瘤中国患者获得早期的、深程度的、持久的缓解。
原始出处:
Jian-Qing Mi, et al. Phase II, Open-Label Study of Ciltacabtagene Autoleucel, an Anti–B-Cell Maturation Antigen Chimeric Antigen Receptor–T-Cell Therapy, in Chinese Patients With Relapsed/Refractory Multiple Myeloma (CARTIFAN-1). Journal of Clinical Oncology. October 21, 2022. https://ascopubs.org/doi/full/10.1200/JCO.22.00690
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












学习了
33