姜新教授推荐|申若琳:FTO通过改变非小细胞肺癌中FAP的m6A水平以诱导整合素/FAK信号传导来促进癌症转移
2024-03-31 医悦汇 医悦汇 发表于陕西省
本期文献内容由吉林大学第一医院姜新教授课题组成员申若琳分享《FTO通过改变非小细胞肺癌中FAP的m6A水平以诱导整合素/FAK信号传导来促进癌症转移》,以供交流!
编者按:肺癌是一种恶性肿瘤,临床发病率和死亡率很高,在全球范围内每年都在上升。尽管非小细胞肺癌(NSCLC)的抗肿瘤治疗取得了进展,但预后仍不令人满意。肿瘤转移是预后不良的重要决定因素。大多数病例(约57%)在诊断时已经处于晚期,因为在疾病早期常无症状,这些患者的5年相对生存率为6%。高转移率及其对生存率的负面影响凸显了深入了解其发病机制和新疗法的迫切需求。
本期文献内容由吉林大学第一医院姜新教授课题组成员申若琳分享《FTO通过改变非小细胞肺癌中FAP的m6A水平以诱导整合素/FAK信号传导来促进癌症转移》,以供交流!
研究背景
癌症细胞要经历遗传和表观遗传变化以获得转移能力。N6-甲基腺苷(m6A)修饰,又称N6位点腺苷的甲基化,是最普遍、最丰富、最保守的内部转录物修饰,尤其是在真核信使核糖核酸(mRNA)中。甲基转移酶、去甲基化酶和m6A结合蛋白参与mRNA的可逆m6A修饰过程。动态m6A修饰对许多生物过程至关重要,新出现的证据表明,m6A失调与癌症的发生、发展、转移、耐药性和癌症复发相关。
脂肪量和肥胖相关蛋白(FTO)是第一种与m6A去甲基化相关的酶,以前被认为与脂肪酸代谢高度相关。FTO的失调通过m6A依赖性机制导致肿瘤发生。FTO在大多数癌症类型中上调并表现出促肿瘤作用,包括急性髓细胞白血病(AML)、乳腺癌、肝癌、胃癌和结直肠癌。然而,FTO在NSCLC中的表达仍存在争议。Shi,Li等人发现,FTO在NSCLC中过表达并通过激活KRAS信号传导或者以m6A依赖的方式上调泛素特异性蛋白酶7(USP7)以促进增殖。FTO在肺鳞状细胞癌(LUSC)中过表达并上调髓系锌指蛋白1(MZF1),通过降低m6A水平,促进细胞增殖和转移。过表达的FTO通过抑制NSCLC中的m6A修饰上调细胞周期相关转录因子-1(E2F1),加速NSCLC的进展。相反,肺腺癌(LUAD)的FTO减少,且与生存率低呈负相关。由WNT信号诱导的EZH2/β-连环蛋白复合物与FTO启动子区的LEF/TCF结合元件结合,抑制LUAD中FTO的表达水平。Ning等人发现,在LUAD中,低表达的FTO以m6A-YTHDF2依赖的方式抑制人类植物同源指蛋白1(PHF1),进一步抑制LUAD的肿瘤发生。此研究旨在探讨FTO在NSCLC中的表达及其作为m6A去甲基化酶在NSCLC转移中的作用。
黏着斑激酶(FAK)是一种非受体酪氨酸激酶,主要受整合素信号调控。在人类转移性癌中发现FAK的表达水平增加和/或FAK激活。Zhao等人报道,CUL5-SOCS3复合物的缺乏诱导了整合素β1的沉积,随后激活了FAK/SRC信号,增强了小细胞肺癌(SCLC)的转移。另一项研究显示,DGKA与SRC/FAK复合物相互作用并活化,促进上皮-间充质转化(EMT)和血管生成,随后促进NSCLC转移[25]。FAK是癌症侵袭和转移的关键调节因子。John C等人报道,FAK抑制剂可被视为对抗化疗、放疗、靶向治疗或靶向免疫微环境治疗获得性耐药的潜在策略。Defactinib(VS6063),一种高效的第二代FAK抑制剂,其在KRAS突变型NSCLC患者中的II期临床试验已经完成。据报道,defactinib单药治疗显示出适度的临床活性,并且总体耐受性良好。
在此,作者报道了FTO的上调与NSCLC的转移和低生存率相关。FAK抑制剂defactinib(VS6063)抑制由FTO过表达诱导的NSCLC转移。从机制上讲,FTO通过以YTHDF2依赖的方式改变FAP的m6A水平来促进NSCLC转移。此外,FTO介导的转移形成依赖于FAP和整合素家族成员之间的相互作用,这进一步激活了FAK信号传导。
研究结果
结果一 FTO的高表达预示着NSCLC的不良预后,并促进肿瘤细胞在体外的迁移和侵袭
为了检测FTO在NSCLC中的表达及其潜在的临床意义,作者对44例配对的NSCLC组织和癌旁组织进行了研究。qRT-PCR和蛋白质印迹结果显示,与癌旁组织相比,NSCLC组织中FTO mRNA和蛋白质表达水平显著增加(图1a和3b)。来自人类蛋白质图谱数据库的免疫组织化学染色显示,在NSCLC组织中观察到FTO中度染色的细胞,而在正常对照组织中观察到低染色(图1b)。与NSCLC组织的结果一致,与BEAS-2B细胞相比,NSCLC细胞系中的FTO mRNA和蛋白质表达水平显著升高(图1d)。此外,来自GEO数据库的数据(GSE26939)揭示了FTO上调与NSCLC患者较短的总生存期(OS)相关(图1c)。KEGG通路分析显示,FTO过表达与细胞转移相关通路的富集有关,包括黏着斑、粘附连接和WNT信号通路(图1e)。这些发现表明,FTO的过表达预示着不良预后,并在NSCLC中起着促转移作用。
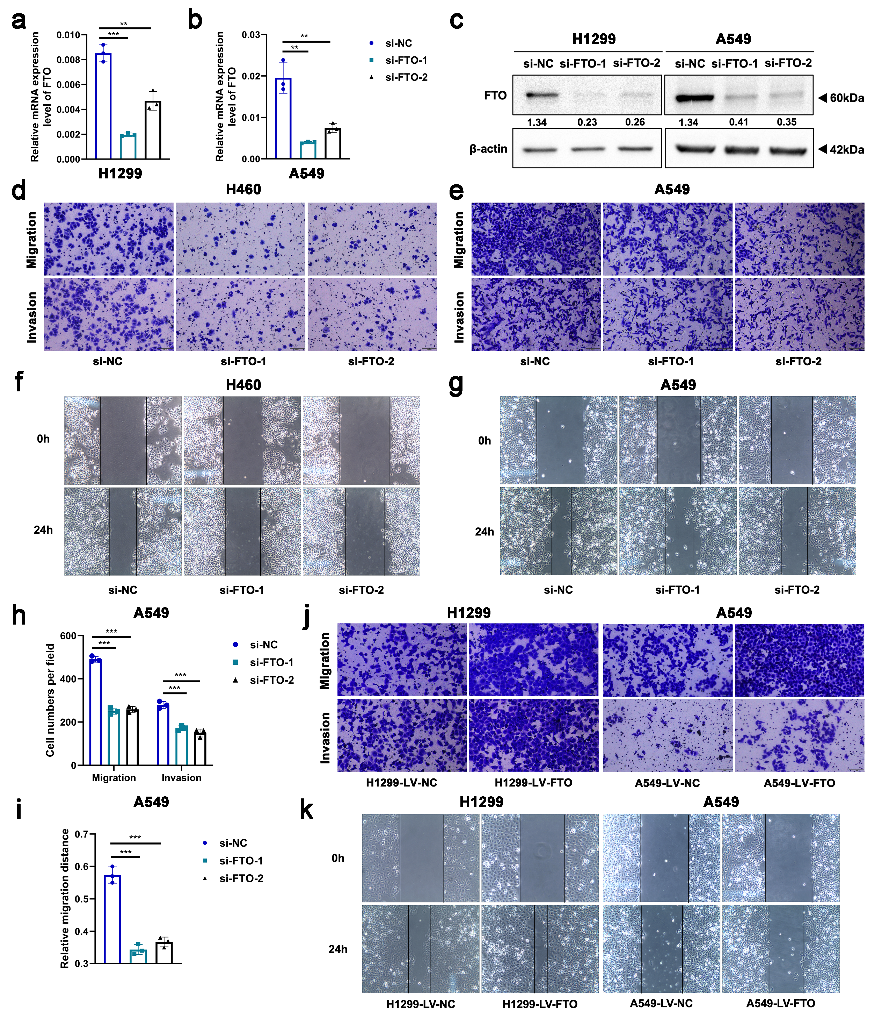
作者最初在H460、H1299或A549细胞系中敲低或稳定过表达FTO,以验证其在细胞迁移和侵袭中的作用。这些细胞系显示出FTO mRNA和蛋白质表达水平的改变(图1f,图S1a-c)。Transwell和伤口愈合测定表明,FTO敲低抑制了细胞迁移和侵袭(图1g-h,图S1d-i)。相反,在FTO过表达的细胞中,细胞迁移和侵袭显著增强(图1i-k,图S1j-k)。蛋白质印迹分析进一步证实,FTO可以调控NSCLC中EMT相关蛋白的表达水平,包括Snail、Slug和N-钙粘蛋白(图1l)。总之,FTO在体外可促进NSCLC细胞的迁移和侵袭。
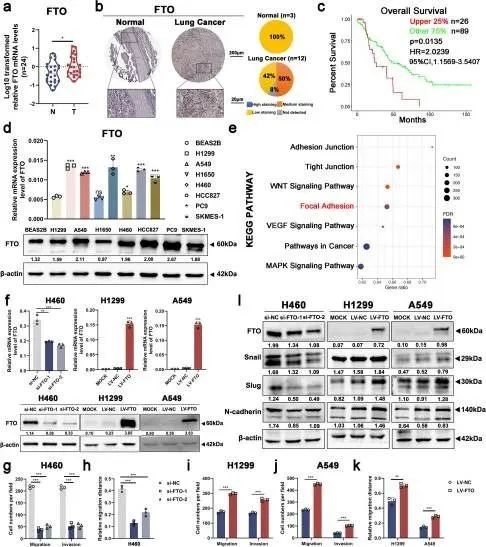
图1
图S1
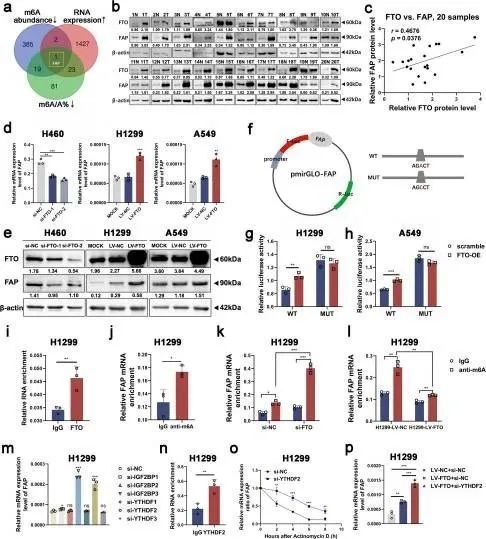
图3
结果二 FAK抑制剂defactinib(VS6063)可抑制体内FTO过表达诱导的NSCLC转移
FTO可以促进NSCLC细胞的迁移和侵袭,因此FTO促进NSCLC肿瘤转移的潜在机制有待进一步研究。KEGG通路分析显示,在FTO过表达水平的细胞中,黏着斑通路富集(图2a),这表明FTO可以激活FAK信号通路。蛋白质印迹分析进一步显示,FTO敲低抑制了磷酸化FAK(p-FAK)的表达水平,而FTO的过表达显著提高了p-FAK的表达水平(图2b)。
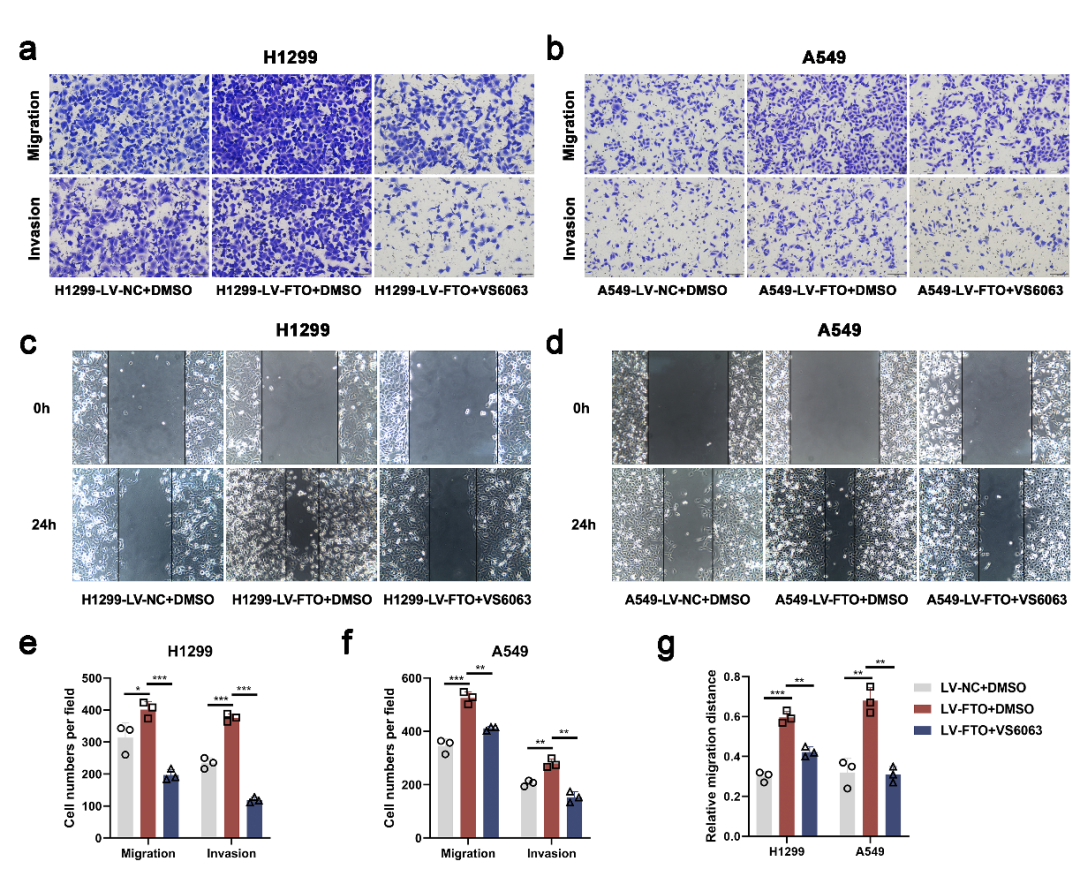
随后,作者将研究扩展到FAK抑制剂的使用和NSCLC转移的新治疗方案。Defactinib(VS6063)是一种选择性FAK抑制剂。用DMSO或VS6063(5μmol/L)处理FTO过表达细胞和对照细胞,并用于进一步分析。Transwell和伤口愈合测定表明,FAK抑制剂治疗逆转了FTO过表达诱导的过度细胞迁移和侵袭(图S2a-g)。
然后作者进行了体内转移测定。向BALB/c裸鼠静脉内注射FTO过表达和对照A549细胞以建立NSCLC转移的体内模型,然后在注射后第五周开始给予DMSO或FAK抑制剂defactinib(VS6063)(25mg/kg,每日)灌胃给药。接种后八周,作者对小鼠实施安乐死,并切除它们的肺以评估转移潜力(图2c)。在接种前重新测定FTO过表达和对照A549细胞中FTO的mRNA和蛋白表达水平(图2d)。与接种对照A549细胞的小鼠相比,接种FTO过表达A549细胞的小鼠发生更多的肺转移结节和微转移病灶(图2e-g)。此外,在接种FTO过表达A549细胞的小鼠中,VS6063治疗组观察到的肺转移结节和微转移病灶比DMSO治疗组少,表明FTO的促转移作用被FAK抑制剂阻断(图2e-g)。总之,体内实验表明,FAK抑制剂defactinib(VS6063)可以抑制由FTO过表达诱导的NSCLC转移,这表明了一种新的NSCLC转移治疗策略。
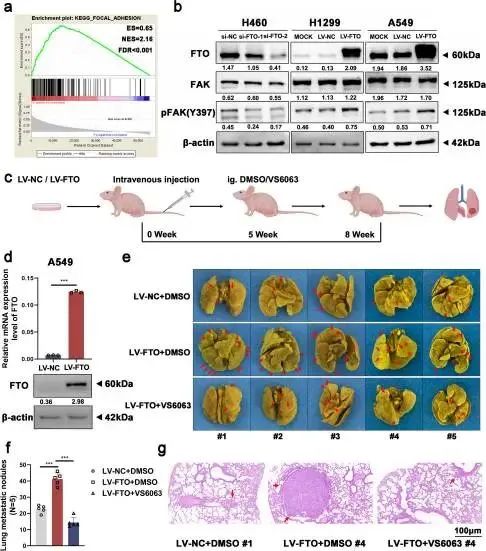
图2
图S2
结果三 FTO以m6A-YTHDF2依赖的方式修改FAP的m6A水平
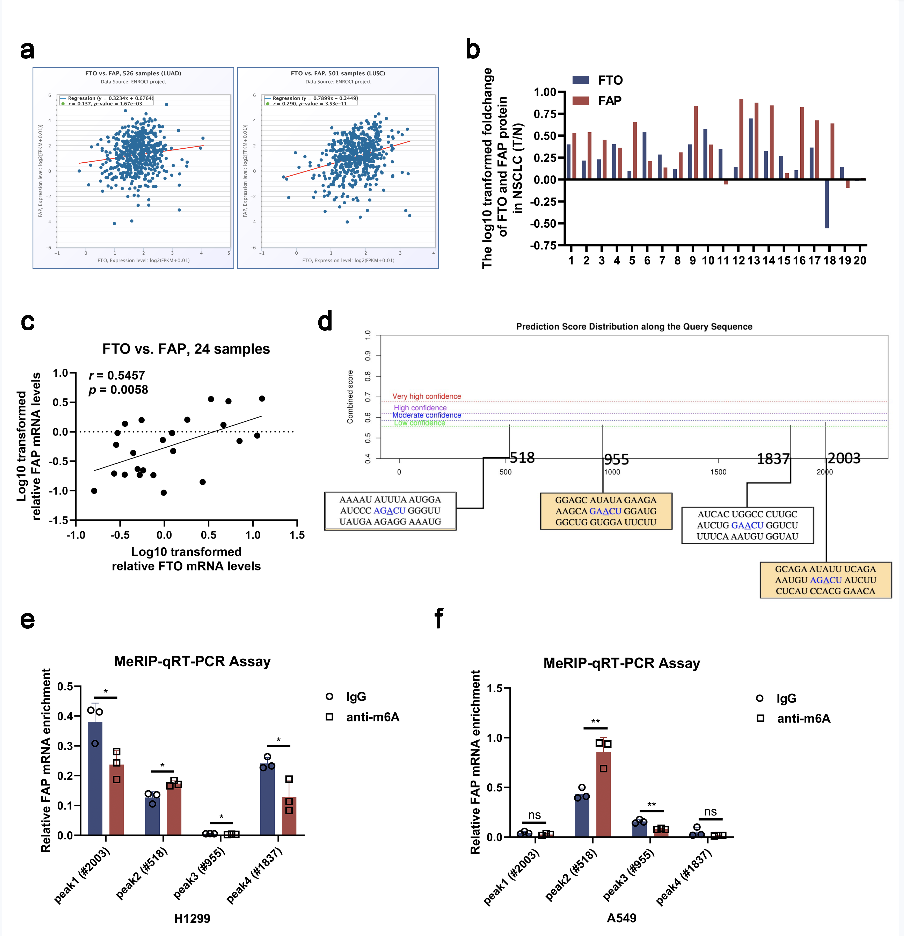
为了阐明FTO调控FAK信号通路的具体分子机制并确定其在NSCLC中的下游靶点,作者进行了人类m6A表转录组微阵列来绘制NSCLC中m6A的修饰。具有低甲基化m6A峰的mRNA转录物可能是FTO的潜在靶标,因为FTO是m6A去甲基化酶。然而,在癌和癌旁组织之间,FAK的m6A水平没有显著差异。通过将m6A修饰的绝对丰度和百分比降低的基因以及表达上调(变化大于1.5倍)的基因进行重叠,作者确定成纤维细胞活化蛋白(FAP)是FTO的潜在下游靶标(图3a)。与测序分析结果一致,结果显示,在NSCLC样本、细胞系和TCGA数据中,FTO和FAP在mRNA和蛋白质表达水平上呈正相关(图3b-e,图S3a-c)。RIP分析结果表明,FTO可以特异性结合FAP,这初步验证了FTO在FAP的m6A修饰中起着重要作用(图3i )。
为了进一步探索这种效应,作者进行了MeRIP,并用qRT-PCR分析了产物。作者使用SRAMP在FAP mRNA中发现了四个推定的m6A修饰位点(图S3d),并提前为下一步的MeRIP qRT-PCR设计了m6A特异性引物。在MeRIP qRT-PCR测定中,H1299细胞中的抗m6A抗体显著富集了FAP mRNA(图3j)。正如预期的那样,在FTO敲低后,FAP mRNA表达显著增加,而FTO过表达显著降低了FAP mRNA的表达(图3k-l)。此外,MeRIP qRT-PCR分析显示位点#518(峰2)是FAP转录物中最可靠的修饰区(图S3e-f)。随后,作者用胞嘧啶(C)取代FAP mRNA的m6A共有序列的#518位点的N6-甲基化腺苷(A),以建立对m6A修饰具有抗性的FAP突变体(图3f)。荧光素酶报告基因测定结果显示,在FTO过表达的细胞中,野生型FAP的荧光素酶活性显著增加,而在突变细胞中,这种增加几乎完全消失(图3g-h),表明FAP表达受到位点#518处FTO相关m6A修饰的调节。
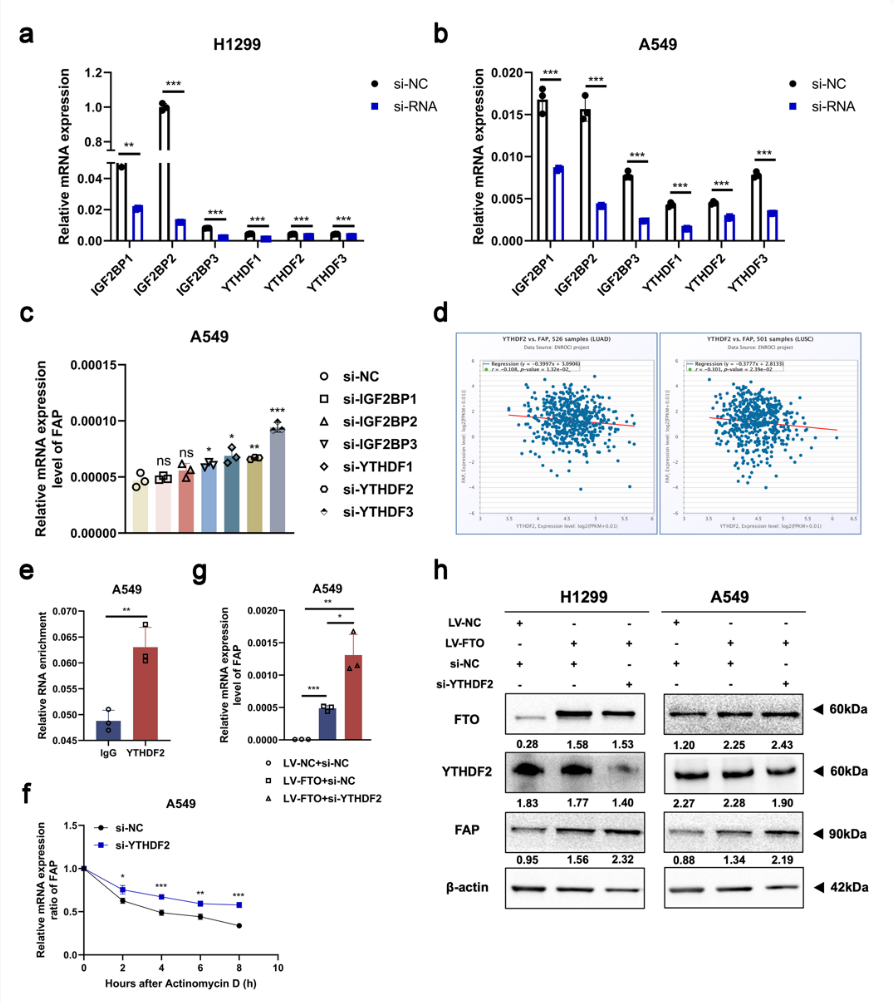
尽管m6A修饰可以通过“甲基转移酶”和“去甲基化酶”进行调节,但m6A修饰依靠生物过程中的“m6A结合蛋白”来发挥转录后调节的强大作用,它们在识别m6A修饰后可以提高mRNA翻译效率或影响mRNA稳定性。随着m6A修饰水平的降低,FAP的表达显著增加,这表明m6A结合蛋白参与了FAP的修饰并且对甲基化产生负面影响。早期研究证明YTHDF2降低了mRNA的稳定性,并促进了靶mRNA衰变。然后,作者敲除最常见的“m6A结合蛋白”,并通过qRT-PCR检测FAP mRNA的表达水平。结果显示,敲低YTHDF2显著上调H1299和A549细胞中FAP mRNA的表达(图3m,图S4a-c)。在TCGA数据库中,FAP的表达与YTHDF2的表达呈负相关(图S4d)。IGF2BP3敲低细胞显示FAP表达升高(图3m,图S4a-c),而先前也有研究报道IGF2BP3与mRNA稳定和翻译有关。所以作者假设是YTHDF2而不是IGF2BP3参与了FAP的RNA识别。此后,作者使用抗YTHDF2的抗体进行RIP测定。结果表明,YTHDF2可以在H1299和A549细胞中特异性结合FAP(图3n,图S4e),这揭示了YTHDF2在FAP的m6A修饰中的关键作用。H1299和A549细胞中的YTHDF2敲低后,FAP mRNA的稳定性得到改善(图3o,图S4f),表明YTHDF2可以促进FAP mRNA降解。此外,在FTO过表达的NSCLC细胞中,作者敲低了YTHDF2,并注意到这些细胞中FAP mRNA和蛋白质表达水平增加(图3p,图S4g-h)。总之,FTO被认为通过消除m6A-YTHDF2依赖性的mRNA降解来增加FAP的表达水平。
图S3
图S4
结果四 FAP过表达可预测NSCLC的不良预后并促进细胞在体外的迁移和侵袭
作者还检测了FAP在相同组织和细胞系中的表达水平。在NSCLC组织中FAP的表达水平明显高于癌旁组织中的表达水平(图3b和4a),这与细胞系中的结果(图4e)以及TCGA和HCMDB数据库分析(图4b-c)兼容。基于在线UALCAN数据库,作者发现临床分期越高,FAP的表达水平越高(图S5a-c)。此外,Kaplan-Meier OS曲线显示,FAP的上调与NSCLC的低生存率相关(图4d)。KEGG分析表明,FAP过表达与细胞转移相关途径的富集有关,包括黏着斑、细胞粘附分子和TGF-β信号通路(图4f)。这些发现表明,FAP的过表达预示着不良预后,并在NSCLC中起着促转移的作用。
为了揭示FAP在细胞迁移和侵袭中的作用,作者分别成功构建了FAP敲低和FAP过表达的H460、H1299和A549细胞系(图4g)。Transwell和伤口愈合测定用于评估细胞迁移和侵袭能力。研究表明,细胞迁移和侵袭在FAP敲低的细胞中受到抑制(图4h-i,图S5d-e),但在FAP过表达的细胞中增强(图4j-l,图S5f-g)。如蛋白质印迹分析所示,在FAP敲低或过表达后,包括Snail、Slug和N-钙粘蛋白在内的EMT相关蛋白的表达水平都发生了改变(图4m)。总之,FAP在体外可促进NSCLC细胞的迁移和侵袭。
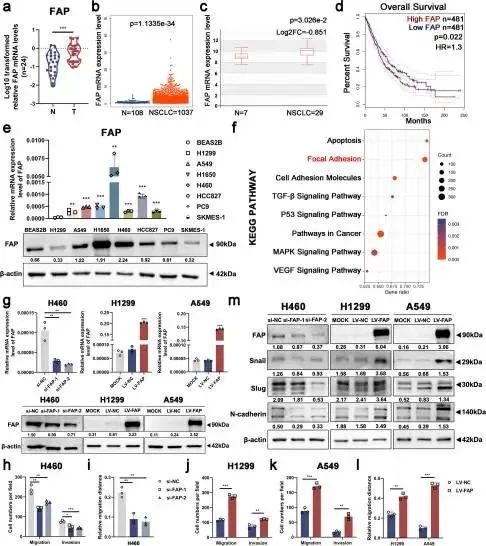
图4
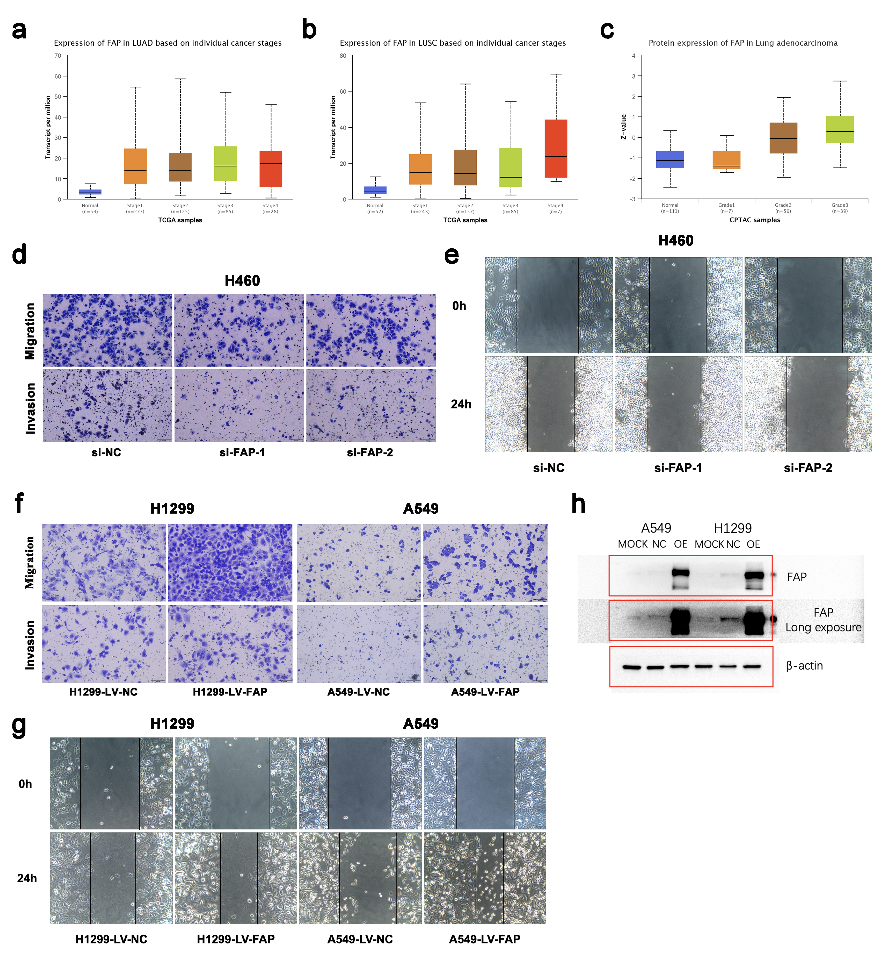
图S5
结果五 FTO通过FAP激活FAK信号通路
KEGG通路分析还揭示了FAP过表达细胞中黏着斑通路的富集(图5a),这表明FAP可以激活FAK信号通路。p-FAK的表达水平通过FAP敲低或过表达而显著改变(图5b)。然后作者用FAK抑制剂处理过表达FAP的细胞。在蛋白质印迹分析中,VS6063处理显著降低了p-FAK的表达水平(图5i)。此外,Transwell和伤口愈合测定表明,FAK抑制剂逆转了由FAP过表达诱导的过度活跃的细胞迁移和侵袭(图5c-e,图S6a-d)。这些发现证实了FAK抑制剂阻断了FAP诱导的异常激活。
随后,作者进行了挽救实验,以确定NSCLC中FTO/FAP/FAK调节轴的存在。在过表达FAP的细胞和对照细胞中转染FTO siRNA,发现敲低FTO挽救了异常改变的FAP和p-FAK水平(图5j)。Transwell和伤口愈合测定还表明,减少FTO表达逆转了FAP过表达诱导的过度活跃的细胞迁移和侵袭(图5f-h,图S6e-h)。综上所述,FTO通过FAP激活FAK信号通路。
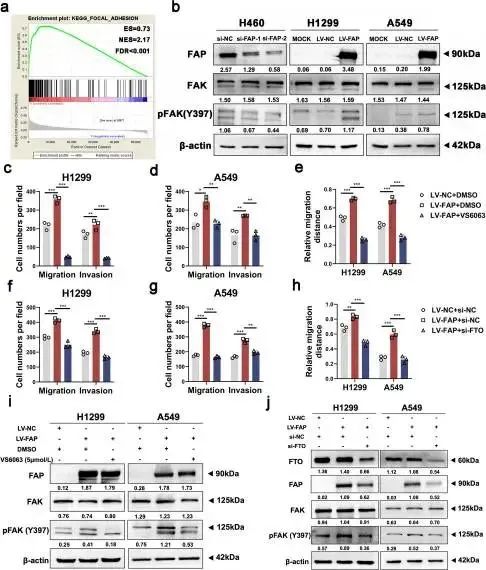
图5

图S6
结果六 整合素信号传导参与FAP诱导的FAK通路激活
为了进一步探索FAP诱导的FAK通路激活的潜在分子机制,作者从TCGA数据库中提取了FAP mRNA表达数据,使用FunRich软件(3.1.3版)进行功能分析。对提取数据的分析表明,按照LogFC值从高到低的顺序排列,FAP与整合素信号传导尤其是β1整合素细胞表面的相互作用(图6a)密切相关。据报道,整合素簇是激活FAK信号传导的关键事件之一。FAP作为一种细胞表面丝氨酸蛋白酶,与整合素α3β1和uPAR信号复合物相互作用,介导卵巢癌细胞迁移。因此,作者假设FAP可以与整合素α3β1相互作用,导致NSCLC转移中FAK的激活。作者使用免疫共沉淀(co-IP)进一步研究了FAP和整合素之间的直接关系,结果表明,在NSCLC细胞中,FAP与整合素α3β1特异性相互作用(图6b)。然后,作者通过Transwell和伤口愈合测定发现,整合素β1和整合素α3的敲低抑制了FAP过表达诱导的过度细胞迁移和侵袭(图6c-h,图S7a-h)。此外,通过蛋白质印迹分析确定,整合素β1和整合素α3的敲低降低了由FAP诱导的p-FAK表达水平的异常增加(图6i-j)。这些结果表明,FAP通过与整合素α3β1相互作用激活FAK信号通路。
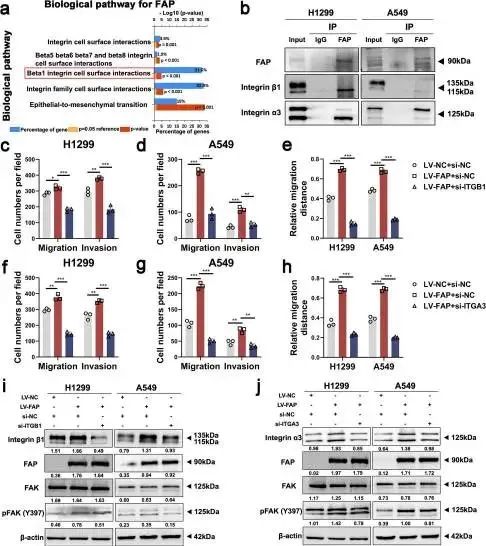
图6
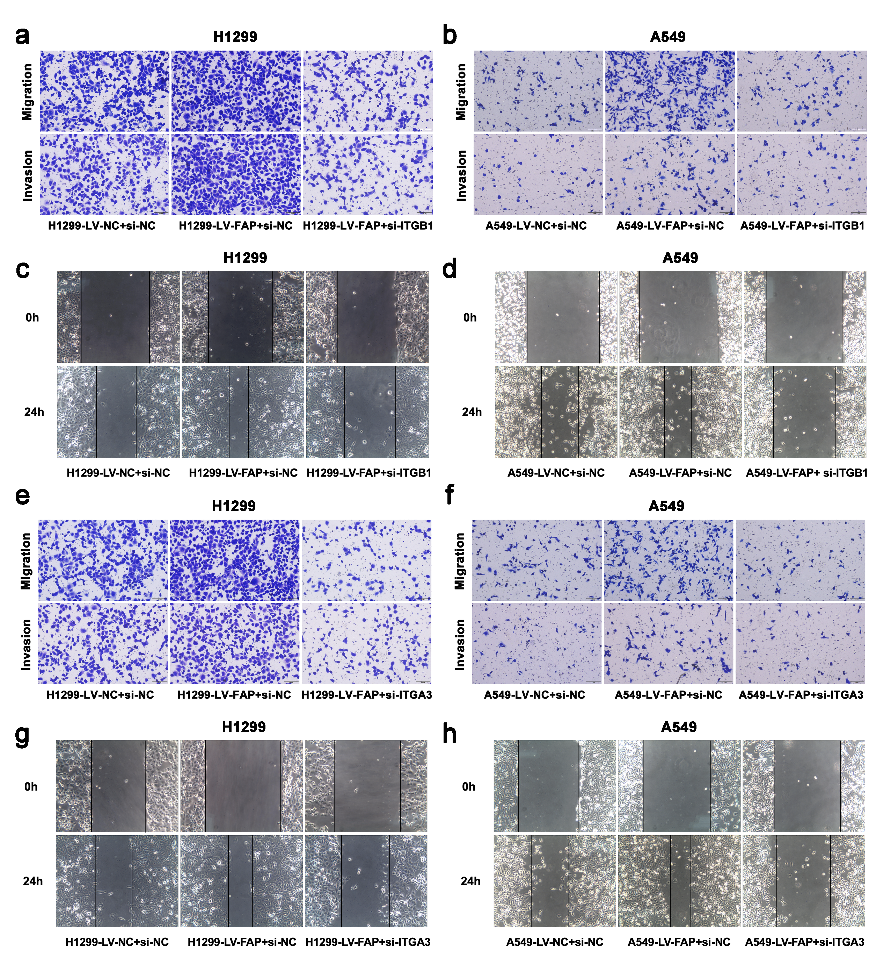
图S7
研究结论
1. FTO在NSCLC中上调,以YTHDF2依赖的方式改变FAP的m6A水平来促进NSCLC中的细胞迁移和侵袭,还可以作为预测患者不良预后因素。
2.FTO介导的转移形成依赖于FAP和整合素家族成员之间的相互作用,进一步激活FAK信号传导,而FAK抑制剂defactinib(VS6063)可以抑制由FTO过表达诱导的NSCLC转移。
原文出处:
Gao L, Wang A, Chen Y, Cai X, Li Y, Zhao J, Zhang Y, Zhang W, Zhu J, Zeng Y, Liu Z, Huang JA. FTO facilitates cancer metastasis by modifying the mA level of FAP to induce integrin/FAK signaling in non-small cell lung cancer. Cell Commun Signal. 2023 Nov 2;21(1):311. doi: 10.1186/s12964-023-01343-6. PMID: 37919739; PMCID: PMC10623768.6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#非小细胞肺癌# #m6A水平# #癌症转移#
24