Blood Cancer J:NGS MRD作为AML初始化疗后的预后标志物
2023-05-01 聊聊血液 网络 发表于上海
NGS MRD作为AML初始化疗后的预后标志物。
大多数急性髓系白血病 (AML) 患者在强化诱导化疗后可达到形态学完全缓解 (CR),但约半数患者之后复发,后续预后较差。这种高复发率意味着治疗后残留白血病克隆的低水平持续存在,而常规疾病监测方法无法检测到。通过多种不同方法检测治疗后可测量的残留病 (MRD),已被证明是长期疾病结局(复发和死亡)的有效预后生物标志物和早期复发的短期预测因子。
MRD 是 AML 预后的可靠生物标志物,但由于需要 MRD 特异性实验室方法、设备和专业性较高,难以在常规临床诊断实验室中进行验证、标准化和实施,因此很多肿瘤学家和实验室在真实世界中大规模实施 MRD 可能会受到影响。例如,AML MRD的流式细胞术检测技术复杂,难以进行质量控制;体细胞突变的单基因 PCR 检测(如NPM1)懂的技术复杂性较低,但仅适用于少数 AML 患者,因此大多数患者无法采用分子方法监测MRD。而基于多基因 NGS 的 AML 检测在临床诊断实验室中变得常规可用,可以为治疗前 AML 诊断样本的靶向治疗和/或风险分层提供信息。
Richard D. Press教授等假设,最初在 AML 诊断时使用的临床实验室验证的 NGS 检测(用于定义体细胞突变特征),也可用于定义治疗后的分子MRD。在治疗前后使用相同的临床诊断实验室 NGS 检测,可通过减少与常规临床诊断实验室相关的临床和/或经济障碍(常规临床诊断实验室将治疗后样本送至外部转诊实验室),使 MRD 监测应用于更多的 AML 患者。这种当地实验室内部系列检测的手段也有助于确认更多 NGS定义的体细胞突变作为临床有用的 MRD 标志物,从而进一步增强该检测方法对更多患者的适用性。为了在真实世界诊断实验室中评估这一假设,作者使用了经临床验证的相同敏感性 NGS 检测来定义治疗前 AML 患者的体细胞突变特征,随后测量治疗后 MRD并证实其对长期临床结局的预后能力。研究结果近日发表于《Blood Cancer Journal》。


该研究为回顾性、单中心研究,纳入128例符合WHO 诊断标准的 AML 患者(不包括急性早幼粒细胞白血病),均接受了使用相同的经验证的临床检测手段连续 NGS 检测,具体时间为初次AML诊断时和首个诱导化疗疗程后,此外患者需要在诊断时发现至少一个可跟踪的1级或2级体细胞突变(somatic mutation)。
通过在 OHSU 诊断临床实验室对治疗后骨髓样本进行常规形态学、细胞遗传学和/或流式细胞分析,评估患者的治疗反应。完全缓解定义为所有检测方法(骨髓形态学、细胞遗传学/FISH 和流式细胞术)均未检测到白血病。在整个疾病监测期间,对诊断时确定的体细胞突变进行NGS 连续监测(每例患者的中位 NGS 试验为6次)。NGS 分析,诊断样本为外周血或骨髓,治疗后样本为骨髓。根据 ELN 和 NCCN 指南,白血病复发定义为骨髓中原始细胞>5%、外周血中存在原始细胞和/或髓外疾病。
采用定制的 NGS 试验进行基于高通量靶向扩增子的 DNA 测序,靶向42个基因,选择这些基因以证明其在髓系恶性肿瘤(包括急性髓系白血病 (AML)、骨髓增生异常和骨髓增殖性肿瘤)的发生或演变中的致病作用。
患者和疾病特征
128例 AML 患者符合研究入选标准,其中63例 (49%) 为女性。诊断时的中位年龄为58岁。根据 ELN 分类系统,23例 (18%) 为继发性(相对于原发)AML,45例 (35%) 具有不良疾病预后特征。其他患者和疾病特征见表1。诊断后的中位疾病监测随访时间为40个月 ,其中包括每例患者平均5.5份样本,通过 NGS 进行连续疾病监测。

AML突变特征
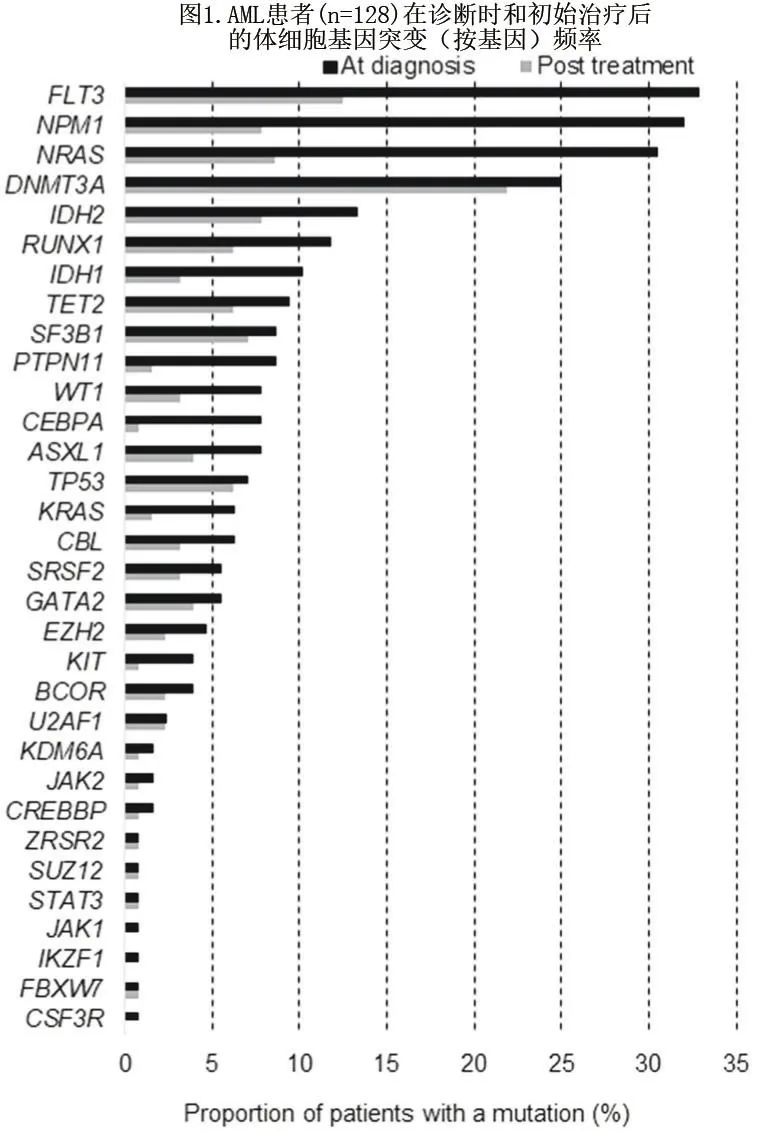
诊断时使用髓系恶性肿瘤的42基因 NGS 检测,在32个独特基因中检测到375个体细胞突变。最常发生突变的基因是FLT3(33%)、NPM1(32%)、NRAS(30%) 和DNMT3A(25%)(图1)。突变频率在10%以上的其他基因包括IDH2(13%)、RUNX1(12%) 和IDH1(10%)。
诊断时大多数患者 (76%) 有≥1个基因携带体细胞突变(每例患者平均2.9个突变)。体细胞 AML 突变的中位变异等位基因频率 (VAF) 为0.40,证实治疗前白血病疾病负荷较高(图2A)。

治疗后的分子学MRD
91例患者 (71%) 的初始诱导化疗采用标准“7+3”方案,其他患者采用各种不同的治疗(表1)。在化疗开始后中位32天进行治疗缓解和 MRD (NGS) 的初始诱导后评估,此时根据常规骨髓形态学、流式细胞术和/或细胞遗传学/FISH 的结果,95例(74%) 达到完全缓解。为尽量减少测定治疗后分子学 MRD 时的分析相关偏倚,在治疗后使用基于 NGS 的 MRD 测定法,其检测限为0.0024 VAF,使用与诊断时完全相同、临床实验室验证的NGS方案和生物信息学分析(在所有可追踪的突变位点增加人工检查)。
初始治疗后 NGS 检测在81例 (63%) 患者中检测到既往在诊断样本中检测到的至少一种体细胞1级或2级突变的残留存在,其中12例在治疗后仅在“前白血病”基因DNMT3A、TET2和/或 ASXL1(DTA) 中携带可检测到的残留体细胞突变;这些基因突变常见于良性年龄相关克隆造血,通常在治疗后持续存在,无预后意义,并被共识专家推荐排除为可靠的分子 MRD 标志物。
69例 (54%) 患者最终归类为 MRD 阳性(不包括 DTA 基因持续突变),他们26个独特基因中有115个残留突变(中位VAF = 0.064)。相比之下,53%诊断时存在的突变在治疗后无法检测,59例 (46%)为MRD 阴性,每例患者的任何非 DTA 基因均未检测到治疗后突变。图2为所有375个可追踪体细胞突变的治疗前和治疗后突变负荷对比。治疗后最常持续存在的突变为DNMT3A(28例患者,但未编为 MRD 阳性)、FLT3(16例患者)、NRAS(11例患者)、IDH2(10例患者)和NPM1(10例患者)(图1和2)。69例 MRD 阳性患者 (n = 43;62%) 中,有超过一半在常规血液病理学检查中达到完全缓解(未检出白血病细胞),证实基于 NGS 的 MRD 手段检测低水平持续性疾病的分析灵敏度更强。
临床结局
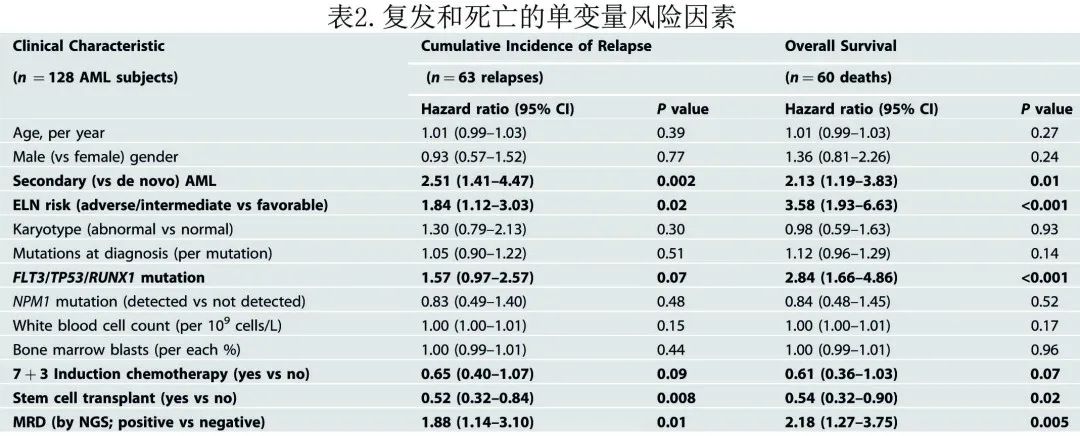
该 AML 队列的诱导后治疗异质性较高,包括51%的患者 (n=65) 接受异基因造血干细胞移植(表1)。初始诱导后 MRD 评估后的中位疾病监测随访时间为39个月,在此期间60例 (47%) 患者死亡,中位至死亡时间为8.5个月,90%的死亡发生在20个月之前。尽管进行了患者特异性优化治疗,但仍有63例患者 (49%) 复发,发生于初次诱导后的 MRD 评估后中位8.0个月。复发患者中有75%(n=47) 随后死亡,复发后中位1.4个月;其他13例患者死于非白血病因素,通常为积极治疗导致的感染或GVHD(诱导后中位8.2个月)。预期可预测不良长期结局(早期复发和死亡)的疾病特征包括 ELN 风险类别、继发性(与原发相比)AML的诊断以及存在已知预后不良基因TP53、RUNX1或 FLT3 突变(表2)。获得更优长期结局的治疗包括使用7 + 3诱导化疗(与其他强度较低的诱导方案相比)和造血干细胞移植巩固治疗。该单中心 AML 队列中证实的预后因素在大型多中心 AML 研究中均显示具有预后性,证实了该组 AML 患者的疾病和治疗参数与其他大型 AML 队列相似。
分子学MRD持续存在可预示长期临床结局较差
与59例清除各已知非 DTA 治疗前体细胞突变的患者(中位OS 未达到)相比,69例在初始诱导化疗后持续可检测到非 DTA 突变的患者(NGS MRD+)的总生存期显著缩短 [中位OS 17个月;P=0.0036;死亡风险比=2.2](图3A)。在控制了非白血病死亡的竞争风险后(n=13),这69名 MRD 阳性患者的至复发时间(中位数13.6个月)仍显著短于 MRD 阴性患者 [未达到中位复发时间;P=0.014;风险比=1.9](图3B)。

为评估持续可检测到诱导后突变 (MRD) 导致的不良预后是否独立于其他预后因素,将表2中与复发和死亡的单变量风险显著增加相关的6个变量纳入多变量分析中,该初步6变量分析包括继发性AML、ELN风险类别、FLT3/TP53/RUNX1突变、使用强化7+3诱导化疗、干细胞移植和 NGS 检测的MRD。在最终模型中,ELN和7+3被排除为复发的独立预测因素(两者P>0.2)。校正继发性AML、FLT3/TP53/RUNX1突变和干细胞移植后,MRD阳性(诱导后NGS持续可检测到突变)是复发 (HR=1.85;P=0.027) 和死亡 (HR=2.04;P=0.013) 的独立预后因素(表3)。此外,持续治疗后 NGS 阳性带来的这种显著的独立过度风险,在数量上与其他3个传统预后不良独立风险因素相似(各自带来的2至3倍过度风险,表3)。

与传统的非分子学方法相比,NGS是一种更好、更灵敏的预后MRD方法
在通过标准血液病理学检查(形态学、流式细胞术和细胞遗传学/FISH)达到诱导后完全缓解的95例 AML 患者中,43例 (45%) 随后死亡,而在33例难治性疾病患者(通过相同方法)中17例 (52%) 随后死亡。基于这些标准指标的完全缓解者与初始诱导治疗无效者的总生存期无显著差异 (P=0.47)(图4A)。95例推定“完全”治疗缓解(通过传统非分子方法)的患者的高死亡率,可能是由于这些患者中43例 (45%) 通过更灵敏的 NGS 方法存在持续的突变阳性 AML 克隆;为了支持这一假设,在这95例初次诱导化疗后完全缓解 (CR) 的患者中,43例 NGS-MRD 阳性 CR 患者的总生存期(中位数17个月)显著短于52例 NGS-MRD 阴性 CR 患者 [中位生存期未达到;P=0.013;风险比2.1](图4B)。

在这项对128例 AML 患者进行的回顾性研究中,患者在诊断时和初始诱导化疗后均接受了相同敏感性的42基因靶向 NGS panel检测,证明在最初接受强化诱导化疗的新诊断 AML 受试者中,诱导期结束时达到 NGS 定义的 MRD 阴性是后续复发和死亡的重要和独立预后标志物。此外通过传统诊断方法只有26%的治疗后 AML 患者为 MRD 阳性(未能达到传统的“完全缓解”),而通过NGS检出54%的患者为 MRD 阳性。
在越来越多的临床诊断实验室中,这些敏感的 MRD 检测的可用性越来越高,应该能够识别出相当一部分(本队列中45%)存在低水平持续疾病的患者(及其相关的较差结局),即使是在达到完全缓解(通过不太敏感的实验室方法)后。鉴于这种有价值的预后信息,未来的临床试验应评估针对 MRD 阳性患者的更强化治疗是否可以改善长期结局而不产生过度毒性。例如在强化诱导化疗后仍为 MRD 阳性的具有初始低危基因特征的 AML 患者中,后续干细胞移植是否会改善复发风险?MRD 分析现在也用于新型诱导和/或巩固治疗的临床试验,作为长期复发和死亡的替代终点,有望加速目前次优、长达十年的药物开发时间线。这些高灵敏度的 NGS 检测将成为定义AML患者最终治疗目标(即疾病根除)的重要工具。
参考文献
Yonghong Li ,et al. NGS-defined measurable residual disease (MRD) after initial chemotherapy as a prognostic biomarker for acute myeloid leukemia.Blood Cancer J . 2023 Apr 24;13(1):59. doi: 10.1038/s41408-023-00833-7.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言