综述:靶向KRAS突变肿瘤:从有药可用到耐药
2023-01-16 精准药物 精准药物 发表于上海
KRAS突变是非小细胞肺癌(NSCLC)、结直肠癌(CRC)和胰腺导管腺癌(PDAC)等多种恶性肿瘤的主要驱动因子。由于缺乏经典的药物结合位点,因此利用药物靶向治疗KRAS突变具有挑战性。
KRAS突变是非小细胞肺癌(NSCLC)、结直肠癌(CRC)和胰腺导管腺癌(PDAC)等多种恶性肿瘤的主要驱动因子。由于缺乏经典的药物结合位点,因此利用药物靶向治疗KRAS突变具有挑战性。中国科学院基础医学与肿瘤研究所程向东/覃江江团队长期关注KRAS突变恶性肿瘤的靶向治疗及临床耐药等问题,并开展了靶向KRAS突变的蛋白降解剂及逆转耐药策略方面的研究工作。程向东/覃江江团队在Molecular Cancer上发表题为《Targeting KRAS mutant cancers: from druggable therapy to drug resistance》的综述性文章,总结回顾了针对KRAS突变的不同药物治疗方法和耐药机制的最新进展,并讨论了联合用药的治疗策略。

论文截图

KRAS生物学:功能和信号传导途径
KRAS是一种小鸟苷三磷酸酶(GTPase),通过将膜生长因子受体与细胞内信号通路和转录因子偶联,在各种细胞过程的分子中充当开关。KRAS信号通路通过参与中央碳代谢、增加葡萄糖摄取和糖酵解来增加营养,同时促进多种分支生物合成途径,为癌细胞提供了竞争优势。KRAS在失活和激活状态之间转变:当KRAS与鸟嘌呤核苷二磷酸(GDP)结合时,它处于失活状态;当它与鸟嘌呤核苷三磷酸(GTP)结合时,它处于激活状态,并激活下游信号通路。因此,KRAS常常被视为调节GDP-GTP的开关。KRAS的上游信号通路主要包括细胞表面受体,它们在受到外界信号后,通过KRAS传递信号,这个过程会刺激细胞增殖和迁移。KRAS的突变会破坏鸟嘌呤交换周期,导致KRAS“锁定”在活跃的GTP结合状态下,从而激活下游信号通路。

KRAS突变型癌症的治疗药物
在过去40年里,KRAS突变被认为不可成药。2021年5月29日,美国食品药品监督管理局(FDA)批准抗癌药物AMG510上市,打破了KRAS突变无靶向药的僵局!AMG510是一种选择性靶向KRAS(G12C)的小分子抑制剂,它特异性不可逆地将KRAS锁定在不活跃的GDP结合状态。而另一款由Mirati Therapeutics研发的KRAS(G12C)的高选择性共价抑制剂MRTX849目前处于I/II期临床研究中。此外,针对其它KRAS突变类型的抑制剂也在陆续开发中,如近期被报导的MRTX1133是一种高选择性非共价的KRAS(G12D)抑制剂。除了上述直接靶向KRAS突变的药物,通过抑制上游或者下游通路中的其它蛋白来间接降低 KRAS活性的药物也开发很多,如靶向抑制SOS1和SHP2这两个RAS信号通路关键靶点的药物。另外,靶向KRAS(G12C)的蛋白降解剂LC-2也被报道有一定治疗效果。KRAS激活和失活的信号转导过程是由各种因子和催化酶所调控。通过抑制因子的功能或酶的活性可以间接降低KRAS的活性,从而达到抑制通路激活的目的。程向东/覃江江团队在其文章同时概括了几种已发现的KRAS上游信号通路抑制剂和KRAS下游信号通路抑制剂并揭示了它们的运作原理。


KRAS突变靶向治疗的耐药机制及联合用药策略
尽管这些KRAS突变抑制剂显示出明显的治疗效果,但在临床使用中还是出现耐药现象。2020年,发表在Nature上的《Rapid non-uniform adaptation to conformation-specific KRAS(G12C) inhibition》向我们揭露了EGFR可以促进KRAS从GDP状态向GTP绑定状态的转换,且AURKA可以通过与KRAS结合来维持其激活状态。2021年,Awad等人在The New England Journal of Medicine上发表了题为《Acquired Resistance to KRASG12C Inhibition in Cancer》的文章,揭示了临床治疗中KRAS二次突变会破坏药物与KRAS结合,造成获得性耐药。此外,旁路代谢途径的反馈性激活也是导致耐药的重要原因,例如当被RTKs信号激活时,KRAS会触发多个级联信号,包括MAPK和PI3K通路,以诱导细胞生长、分裂和分化。上皮细胞向间充质转化、病理类型的转变、癌基因重排等也是导致耐药出现的原因。因此,临床上急需开发出有效的联合治疗方案,以充分对抗在使用MRTX849和AMG510治疗期间出现的获得性耐药。

MAPK/PI3K信号通路及 KRAS抑制剂耐药机制综述。
a KRAS循环和信号通路示意图;b KRAS抑制剂的耐药机制。
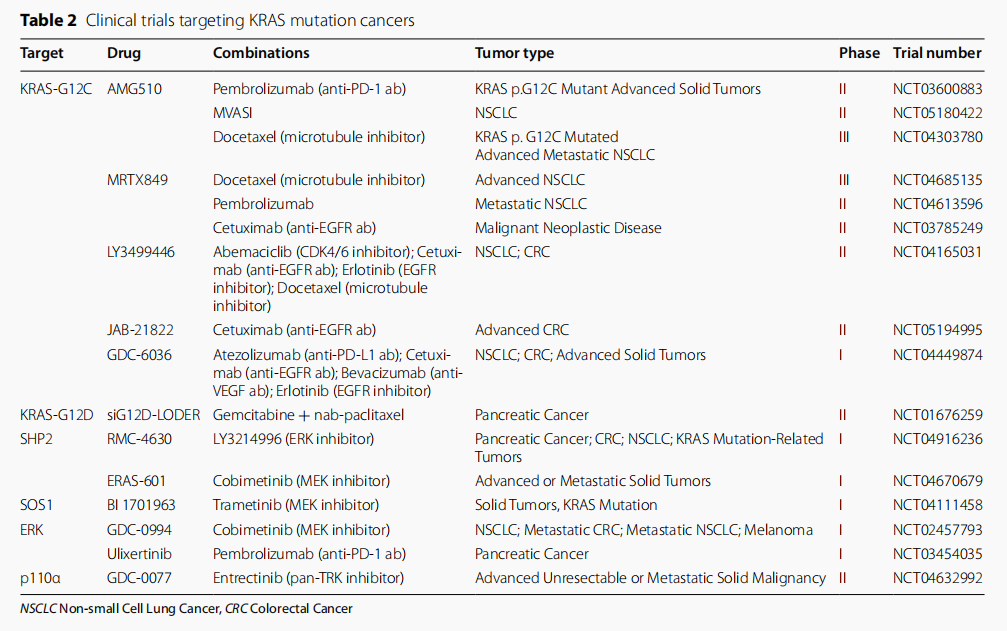
针对 KRAS突变型癌症的临床试验
在过去的40年里,在探索KRAS突变型癌症的治疗征程上人们做了巨大的努力,包括针对KRAS的过表达及其功能、上游调控因子或下游效应器。程向东/覃江江团队在综述文章中详细概括了目前已报道的有关KRAS突变癌症靶向治疗的耐药机制,包括KRAS二次突变、KRAS上下游信号通路的反馈激活、上皮细胞向间充质转化、病理类型的转变以及与免疫损伤相关的耐药机制,并且详尽而有针对性地归纳了已报道或潜在的联合治疗策略,为进一步研究KRAS突变耐药机制和联合治疗提供新的思路。本文共同第一作者为中国科学院大学杭州高等研究院分子医学院硕士研究生朱春晓、浙江省肿瘤医院副研究员管晓庆和浙江工业大学药学院硕士生张喜诺,共同通讯作者为覃江江研究员、张卫东教授和程向东教授。
参考文献:
1. Hofmann MH, Gerlach D, Misale S, Petronczki M, Kraut N: Expanding the Reach of Precision Oncology by Drugging All KRAS Mutants. Cancer Discov 2022, 12(4):924-937.
2. Cook JH, Melloni GEM, Gulhan DC, Park PJ, Haigis KM: The origins and genetic interactions of KRAS mutations are allele- and tissue-specific. Nat Commun 2021, 12(1):1808.
3. Akhave NS, Biter AB, Hong DS: Mechanisms of Resistance to KRAS-Targeted Therapy. Cancer Discov 2021, 11(6):1345-1352.
4. Xue JY, Zhao Y, Aronowitz J, Mai TT, Vides A, Qeriqi B, Kim D, Li C, de Stanchina E, Mazutis L et al: Rapid non-uniform adaptation to conformation-specific KRAS(G12C) inhibition. Nature 2020, 577(7790):421-425.
5. Awad MM, Liu S, Rybkin II, Arbour KC, Dilly J, Zhu VW, Johnson ML, Heist RS, Patil T, Riely GJ et al: Acquired Resistance to KRAS Inhibition in Cancer. N Engl J Med 2021, 384(25):2382-2393.
6. Zhu C, Guan X, Zhang X, Luan X, Song Z, Cheng X, Zhang W, Qin J-J: Targeting KRAS mutant cancers: from druggable therapy to drug resistance. Mol Cancer 2022, 21(1):159.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言