新消化道肿瘤月报等你来读!
2022-12-19 消化界 消化界 发表于安徽省
目前的研究推进了对 CRC 发病的生物学机制的理解,这是确定支持早期 CRC 患者个性化治疗的生物标志物的第一步,但也是必不可少的一步。【原文链接】
本期消化道肿瘤月报,为大家梳理了JCO,GUT共4篇 11 月刊的重点内容。最新研究成果与科研进展等你来看!
J Clin Oncol:
Bemarituzumab 治疗 FGFR2b 选择的胃或 GEJ 腺癌(FIGHT):一项随机、双盲、安慰剂对照的 2 期研究
Bemarituzumab in patients with FGFR2b-selected gastric or gastro-oesophageal junction adenocarcinoma (FIGHT): a randomised, double-blind, placebo-controlled, phase 2 study
背景:HER2 阴性、晚期胃或 GEJ 腺癌患者的预后较差。在这项 FIGHT 研究中,研究人员探索了首创新药无岩藻糖修饰、人成纤维细胞生长因子受体2 IIb亚型(FGFR2)人源化 IgG1 抗成纤维细胞生长因子受体 2 亚型 IIb (FGFR2b)的单克隆抗体 bemarituzumab 与改良 mFOLFOX6(5-氟尿嘧啶、亚叶酸钙联合奥沙利铂)在 FGFR2b 选择的胃或 GEJ 腺癌患者中的疗效和安全性。
患者和方法:在这项随机、双盲、安慰剂对照的 2 期试验 (FIGHT) 中,纳入从 17 个国家/地区的 144 个临床站点招募的 HER2 非阳性、FGFR2b 选择的胃或 GEJ 腺癌患者(年龄在 18 岁及以上,东部肿瘤协作组 [ECOG] 体能状态评分为 0~1 分)。排除既往接受过任何选择性 FGF-FGFR 通路抑制剂治疗的患者。符合条件的患者被以 1:1 随机分配,使用区组随机化(区组大小 = 4)和互动式语音应答系统(IVRS),按地理区域、既往治疗意图以及在筛查 FGFR2b 时是否接受mFOLFOX6 给药进行分层,给予每 2 周静脉注射 bemarituzumab(15 mg/kg)或匹配的安慰剂。所有患者每 2 周静脉注射一次 mFOLFOX6(奥沙利铂 85 mg/m2、亚叶酸 400 mg/m2 和 5-氟尿嘧啶 400 mg/m2 ,随后以 2400 mg/m2 维持约 46 小时)。患者接受治疗直至疾病进展(由实体瘤反应评估标准 [RECIST] 1.1 版定义)、不可接受的毒性、退出试验或死亡。主要终点是意向治疗人群(定义为随机分配接受治疗的所有患者)的无进展生存期。
结果:在 2017 年 11 月 14 日至 2020 年 5 月 8 日期间,该研究对 910 名患者进行了筛查,其中 155 名患者被随机分配到 bemarituzumab组(n=77)或安慰剂组(n=78)。中位年龄为 60.0 岁(四分位距[IQR] 51.0~67.0);包括女性参与者 44 名 (28%) ,及男性参与者 111 名(72%) ;亚裔 89 名(57%) ,白种人 61 名(39%) 。
疗效方面:在进行初步分析和中位随访 10.9 个月 (IQR 6.3~14.2) 时,bemarituzumab 组中位无进展生存期(PFS)为 9.5 个月(95% CI 7.3~12.9) ,安慰剂组中位 PFS 为 7.4 个月(95% CI 5.8~8.4)(风险比 [HR] 0.68 [95% CI 0.44~1.04;p=0.073;图 1 )。截至主要数据截止日期(2020 年 9 月 23 日),bemarituzumab 组的 28 名(36%)参与者和安慰剂组的 40 名(51%)参与者死亡。bemarituzumab 组的中位总生存期(OS)未达到(95% CI 13.8 至未达到),安慰剂组为 12.9 个月(95% CI 9.1~15.0)(HR 0.58 [95% CI 0.35~0.95];p=0.027;图 2)。
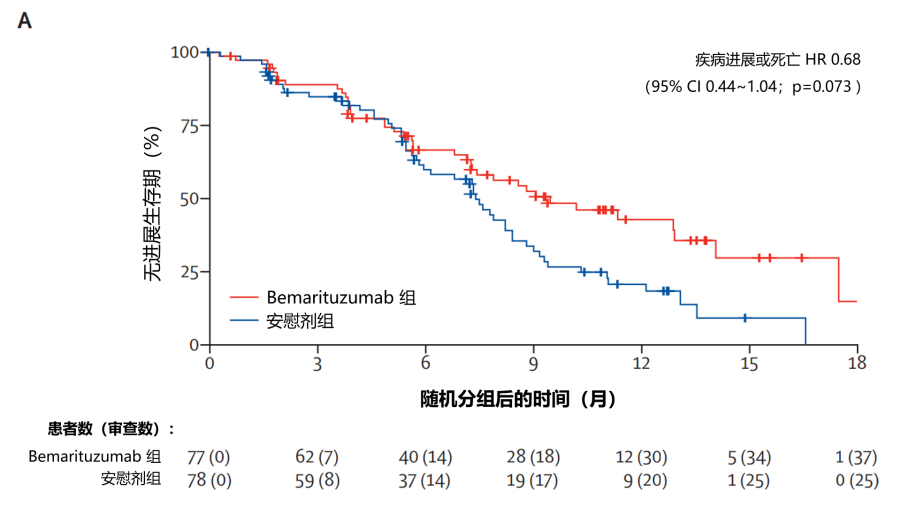
图1:PFS 的Kaplan-Meier生存曲线
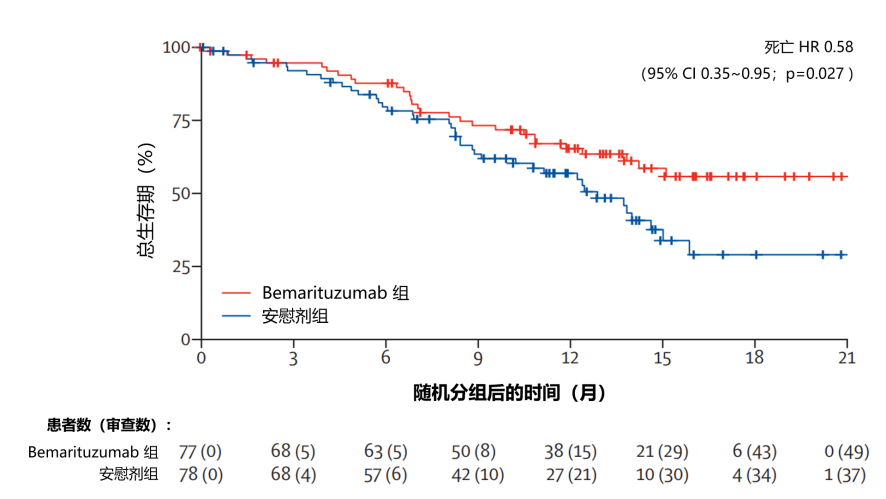
图2:OS 的Kaplan-Meier生存曲线
截至 2020 年 9 月 23 日,bemarituzumab 组的客观缓解率(ORR)为 47%(95% CI 35~59),安慰剂组为 33%(95% CI 23~45),组间差异为 13%(95 % CI -3~29;p = 0.11)。 bemarituzumab 组的中位缓解持续时间(DoR)为 12.2 个月(95% CI 5.5~15.6),安慰剂组为 7.1 个月 (95% CI 4.3~11.7)。在基线时肿瘤可测量的 126 名 (81%) 患者亚组中,基线后至少进行过一次测量的 bemarituzumab 组(n = 59/66)和安慰剂组(n = 53/60)患者的 ORR 分别为 53%(95% CI 40~65)和40%(95% CI 28~54)(图 3)。
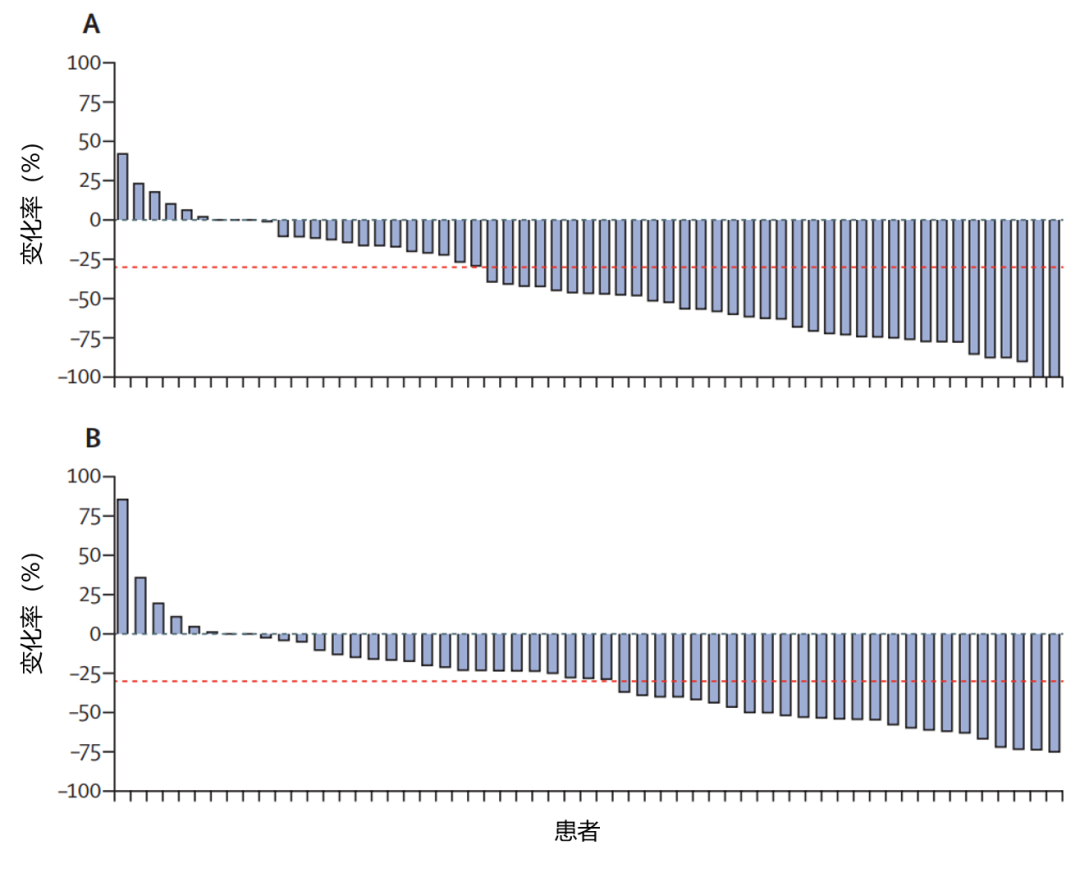
图 3:可测量肿瘤最长直径总和相对于基线的最佳百分比变化
(A:bemarituzumab 组;B:安慰剂组)
安全性:常见的 3 级或更严重的不良事件是中性粒细胞计数减少(bemarituzumab 组 76 人中有 23 人 [30%] vs. 安慰剂组 77 人中有 27 人 [35%])、角膜疾病(18 人 [24%] vs. 无)、中性粒细胞减少症(10 人 [13%] vs. 7 人 [9%])、口腔炎(7 人 [9%] vs. 1 人 [1%])和贫血(6 人 [8%] vs. 10 人 [13%])。bemarituzumab 组和安慰剂组分别有 24 例(32%)和 28 例(36%)患者报告了严重的治疗中出现的不良事件,且分别有 9 例 (12%) 和 15 例 (19%) 患者发生了严重的 mFOLFOX6 治疗相关不良事件。
总结:尽管PFS未得到显著改善,但 bemarituzumab 治疗仍然显示出有临床疗效的希望。 bemarituzumab 联合 mFOLFOX6 的验证性 3 期试验被证实具有统计学意义,目前正在对既往未接受过治疗的 FGFR2b 过表达晚期胃或 GEJ 腺癌患者进行进一步的研究。
【原文链接】
https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(22)00603-9/fulltext
J Clin Oncol:
Trastuzumab Deruxtecan 用于人表皮生长因子受体 2 低表达的胃癌或胃食管结合部腺癌初治患者中的抗人表皮生长因子受体 2 治疗:II 期试验的探索性队列结果
Trastuzumab Deruxtecan in Anti–Human Epidermal Growth Factor Receptor 2 Treatment–Naive Patients With Human Epidermal Growth Factor Receptor 2–Low Gastric or Gastroesophageal Junction Adenocarcinoma: Exploratory Cohort Results in a Phase II Trial
背景:Trastuzumab deruxtecan(T-DXd)是一种抗体-药物偶联物,包含与曲妥珠单抗具有相同氨基酸序列的人源化抗 HER2 免疫球蛋白 G1 单克隆抗体。本研究探索了 T-DXd 在 HER2 低表达的胃或 GEJ 腺癌患者中的疗效和安全性。
患者和方法:DESTINY-Gastric01 是一项多中心、开放标签、三队列的 T-DXd II 期试验,在来自日本和韩国的局部晚期或转移性 HER2低表达胃或 GEJ 腺癌患者(队列 1:HER2 免疫组织化学[IHC] 2+/原位杂交阴性[ISH];队列 2:IHC 1+)中进行。这些患者在之前接受过至少两种既往治疗方案,包括氟嘧啶和铂类,但未接受过抗 HER2 治疗。予每 3 周静脉注射一次 T-DXd 6.4 mg/kg。主要终点是由独立中央审查委员会(ICR)确认的 ORR。
结果:21 名患者被纳入队列 1,24 名患者被纳入队列 2;队列 1 中的 20 名 (95.2%) 患者和队列 2 中的 24 名 (100%) 患者接受了 T-DXd 治疗。
队列 1 中的五个部分缓解患者和队列 2 中的两个部分缓解患者的 ORR 为 26.3%(95% CI,9.1~51.2)和 9.5%(95% CI,1.2~30.4),两个队列中,没有患者达到完全缓解(CR)。队列 1(19 人中的 13 人 [68.4%])和队列 2(20 人中的 12 人 [60%])中大约三分之二的患者通过 ICR 评估发现肿瘤体积缩小,其中队列 1 中的三名患者和队列 2 中的两名患者曾接受过伊立替康治疗(图4)。
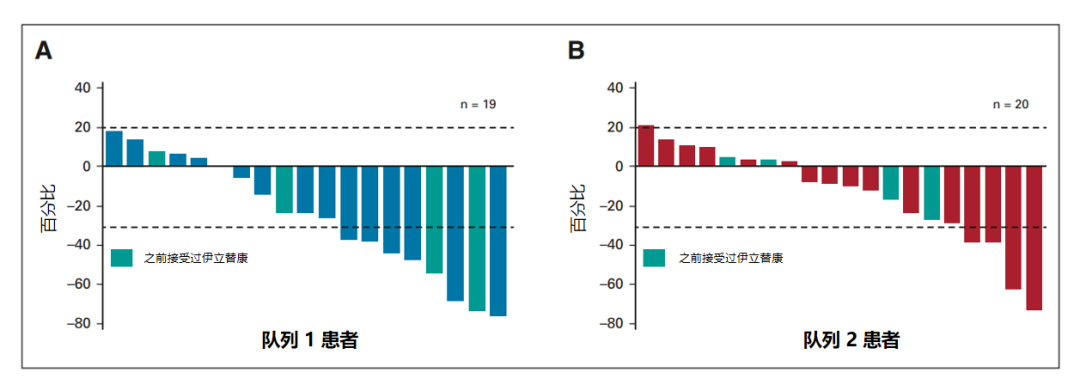
图 4:队列 1 和队列 2 患者肿瘤大小相对于基线的最佳百分比变化
(20% 处的虚线表示进行性疾病;-30% 处的虚线表示部分缓解)
此外,队列 1 的中位 OS 为 7.8 个月(95% CI,4.7 至不可评估),队列 2 为 8.5 个月(95% CI,4.3 至 10.9);中位 PFS 分别为 4.4 个月(95% CI,2.7 至 7.1)和 2.8 个月(95% CI,1.5 至 4.3)(图 5)。
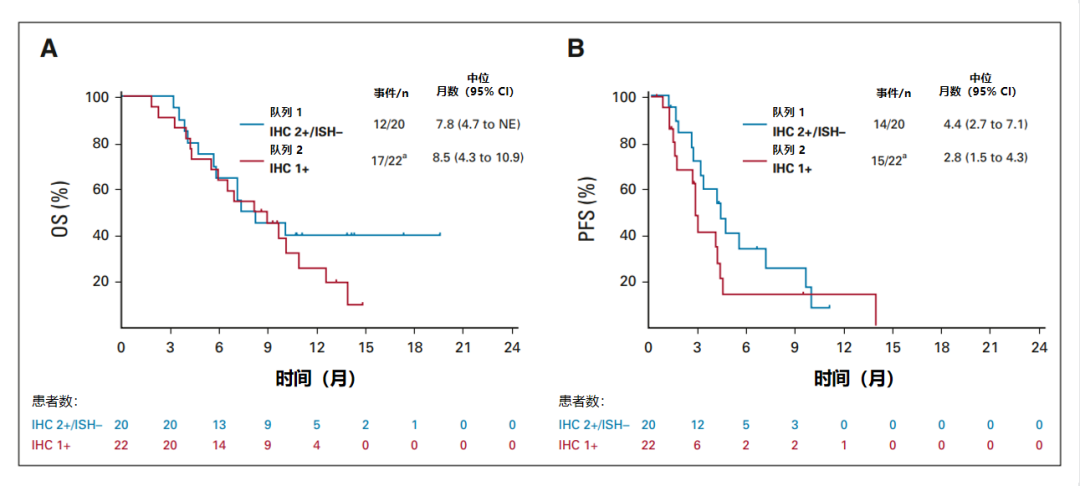
图5:基于 ICR(完整分析集)的 OS 和 PFS 的 Kaplan-Meier生存曲线
队列 1 和队列 2 中最常见的 ≥ 3 级治疗紧急不良事件是贫血(30.0% 和 29.2%)、中性粒细胞计数减少(25.0% 和 29.2%)和食欲下降(20.0% 和 20.8%)。每个队列中有一名患者发生药物相关间质性肺病/肺炎(1 级或 2 级)。没有发生与药物有关的死亡。
总结:该研究表明, T-DXd 在经过大量预处理的 HER2 低表达的胃或 GEJ 腺癌患者中具有临床活性,为 T-DXd 在HER2 低表达的胃或 GEJ 腺癌患者中的疗效提供了初步证据。后续仍需要在更大的队列中进行额外的随机对照试验,以确定 T-DXd 在 HER2低表达胃或 GEJ 腺癌中的疗效和安全性。
【原文链接】
https://ascopubs.org/doi/abs/10.1200/JCO.22.00575?role=tab
J Clin Oncol:
III 期结肠癌辅助治疗中奥沙利铂诱导的周围神经病变的潜在介质:来自 CALGB(联盟)/SWOG 80702 的发现
Potential Mediators of Oxaliplatin-Induced Peripheral Neuropathy From Adjuvant Therapy in Stage III Colon Cancer: Findings From CALGB (Alliance)/SWOG 80702
背景:关于使 CRC 患者易患 OIPN 的临床和社会人口统计学因素,已报告了相互矛盾的发现。本研究试图通过随机临床试验(RCT)在 III 期结肠癌切除患者中评估计划治疗持续时间、塞来昔布的使用、身体活动、体重指数 (BMI)、糖尿病和维生素 B6 摄入量与氟尿嘧啶、亚叶酸钙和奥沙利铂 (FOLFOX) 辅助化疗期间和治疗后自我报告 OIPN 的独立和交互关联。
患者和方法:对参加 CALGB/SWOG 80702 试验的 2450 名 III 期结肠癌患者进行了一项前瞻性观察性研究,随机分配到 2 组,分别接受 6 或 12 个周期的氟尿嘧啶、亚叶酸钙和奥沙利铂辅助化疗,伴或不伴 3 年塞来昔布使用史。在化疗期间和化疗完成后使用常见不良事件评价标准 (CTCAE),以及在随机分组后 15~17 个月使用肿瘤患者神经毒性评估量表(FACT/GOG-NTX-13)报告OIPN。基于基线社会人口学和临床因素调整了多变量分析。
结果:在纳入的 2450 名 CTCAE 报告的神经病变患者队列中,99.8% 的患者在化疗期间至少进行了一次神经病变测量,96.3% 的患者在完成基于奥沙利铂的治疗后至少进行了一次神经病变随访测量。中位治疗后随访时间为 58 个月(IQR,40~68 个月)。1242 名患者完成了 FACT/GOG-NTX-13 神经毒性测量。从奥沙利铂治疗结束到 Q2 完成的中位时间为 12 个月(IQR,10-13 个月)。
接受 12 个治疗周期(相对于 6 个周期;CTCAE 和 FACT/GOG-NTX-13 总分 P < 0.01),治疗后每周锻炼 < 9 小时(相对于 ≥ 9 小时;FACT/GOG-NTX-13 总分 P = 0.003)、BMI ≥ 25 kg/m2(相对于 < 25 kg/m2;治疗期间 CTCAE 评分 P = 0.05,治疗后 CTCAE 评分 P = 0.04)、以及患有糖尿病(相对于未患糖尿病;FACT/GOG-NTX-13 总分 P = 0.002)的患者,明显更有可能发生更高级别的神经病变,且需要花费更长的时间治疗;而塞来昔布和维生素 B6 的摄入量均未显示与 OIPN 的发生相关;奥沙利铂治疗持续时间与任何这些潜在可改变的暴露之间没有显著的相互作用(图 6~8)。
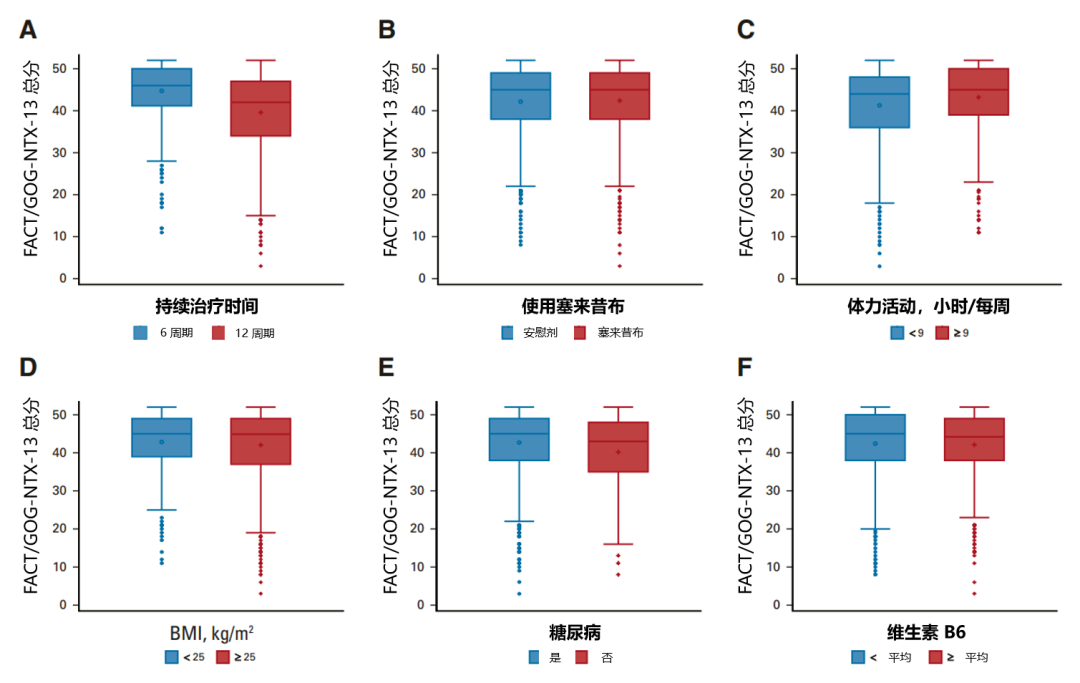
图 6. FACT/GOG-NTX-13 总分与各因素之间的关系
(A:计划治疗持续时间;B:塞来昔布添加;C:体力活动;D:BMI;E:糖尿病;F:维生素 B6 摄入量)
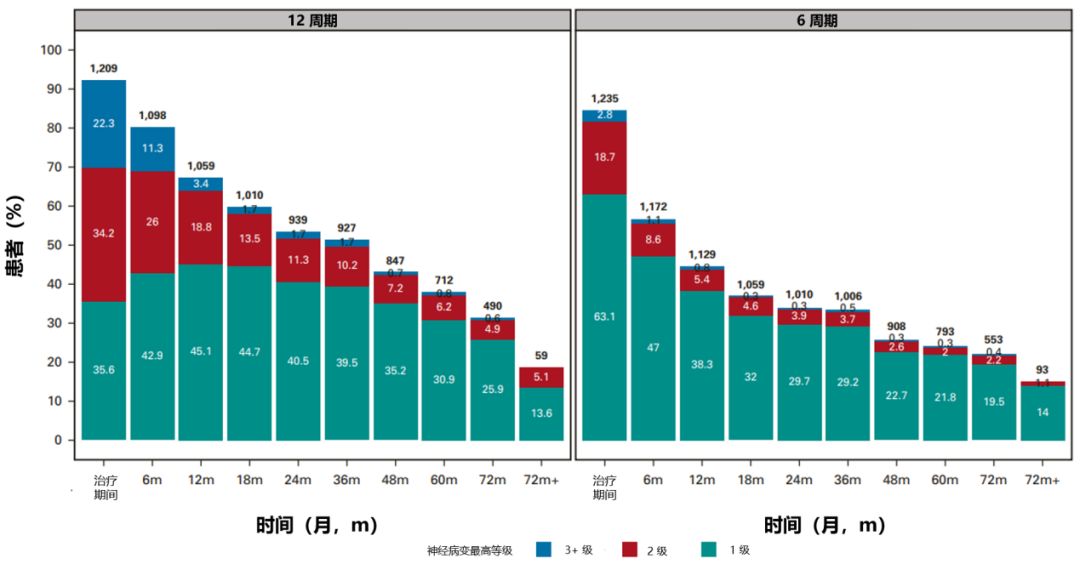
图 7:CTCAE 报告的神经病变与计划治疗持续时间的关系
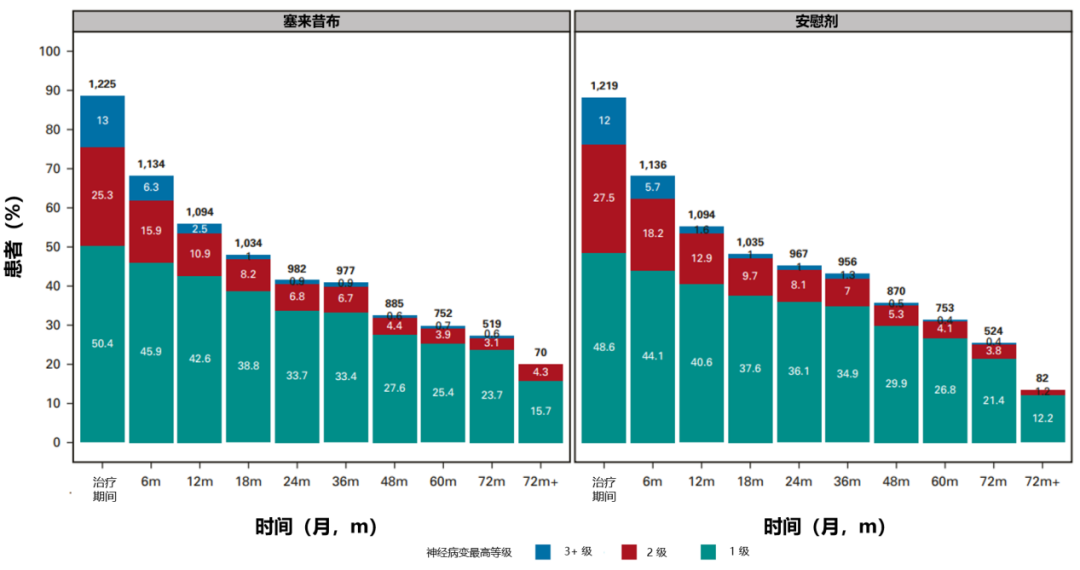
图 8:CTCAE 报告的神经病变与使用塞来昔布的关系
总结:较低的体力活动、较高的 BMI、糖尿病和较长的计划治疗时间可能与 OIPN 严重程度显著增加有关,但与塞来昔布的使用或维生素 B6 的摄入与其无关。
【原文链接】
https://ascopubs.org/doi/abs/10.1200/JCO.22.00575?role=ta
Gut:
转录组学和免疫表型分析揭示结直肠癌肿瘤发生的分子和免疫学特征
Transcriptomic and immunophenotypic profiling reveals molecular and immunological hallmarks of colorectal cancer tumourigenesis
背景:随着对 CRC 生物学见解的逐步发展,开发出针对该疾病的早期确诊患者的个性化检测和最佳临床管理的定制方法势在必行。早期 CRC(例如,pT1 CRC)特别适合通过空间方法进行分析,因为同一病变内存在不同的组织学,包括健康组织、不同程度的异型增生和癌症,从而代表恶性转化的早期过程。本文剖析了伴随 CRC 恶性转化的转录和免疫学改变,并通过 pT1 CRC 样本的空间分析来识别临床相关的生物标志物。
患者和方法:研究人员在 8 个 pT1 CRC 上采用数字空间分析(GeoMx)来研究不同组织学区域(包括正常粘膜、低度和高度不典型增生和癌症)的上皮和间质片段中的基因表达。通过成像质量流式细胞术分析连续的组织学切片以揭示免疫结构。最后,分析公开可用的单细胞 RNA 测序数据以确定相关转录本的细胞来源。患者样本是在莱顿大学医学中心胃肠病科通过内窥镜粘膜下剥离术获得的。患者在内窥镜手术前未接受任何治疗。组织经过福尔马林固定和石蜡包埋(FFPE)。
结果:为了破译 CRC 发病和进展期间发生的分子变化,研究人员使用数字式空间多靶标分析系统(GeoMx DSP)分析了 8 个 pT1 CRC 样本。对于每个样本,选择了 9 个感兴趣区域(ROI),包括正常粘膜、正常粘膜和异型增生之间的过渡区域、低度和高度异型增生区域以及癌组织(图 9)。为了具体检查上皮和间质隔室内的瘤内转录改变,分别检查了每个 ROI 内的细胞角蛋白阳性(PanCK +)和波形蛋白阳性(Vimentin +) 部分(图 10)。CTA 集中的大部分基因在片段之间差异表达:583 个基因在上皮片段中上调,1068 个基因在基质片段中上调(配对 t 检验;Benjamini-Hochberg 法矫正检验,错误发现率[FDR] < 0.05)。
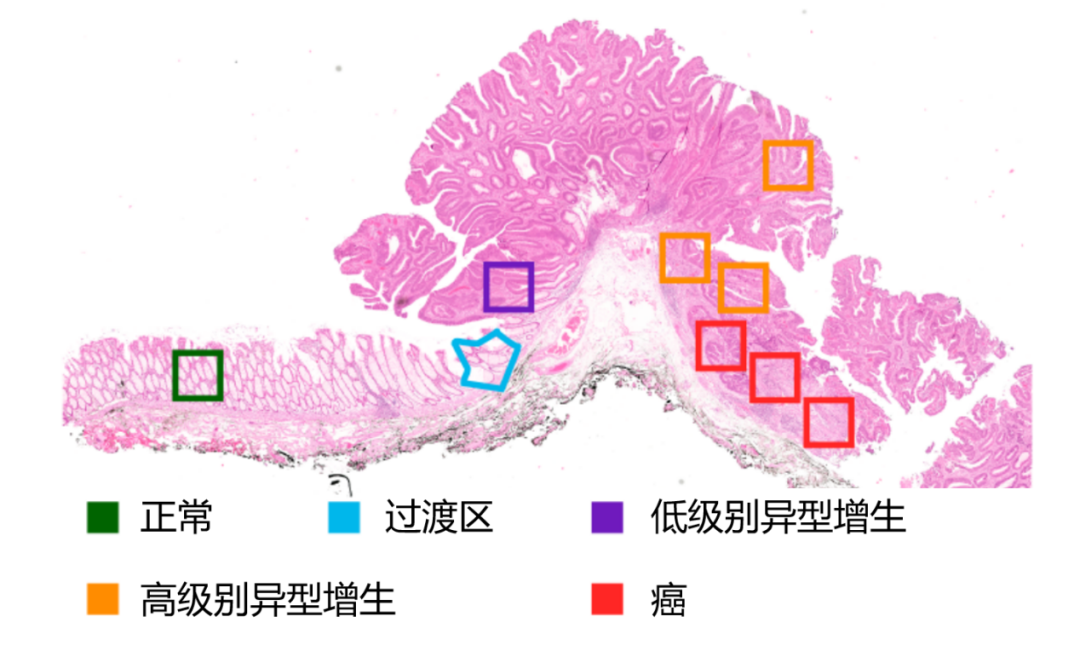
图 9:H&E 染色的 pT1 CRC 样本
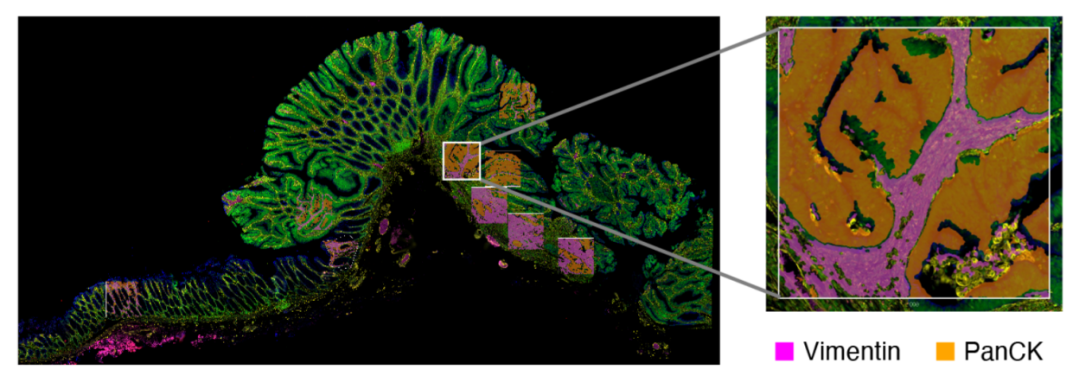
图 10:同一个 pT1 CRC 样本的 PanCK 和波形蛋白免疫荧光检测
为了深入了解与从正常组织到癌的逐步进展相关的基因表达变化,研究人员评估了具有不同组织学的区域之间的差异基因表达,确定了恶性转化过程中炎症反应的早期发作,其典型特征是先天免疫感应等基因特征的上调(图 11)。
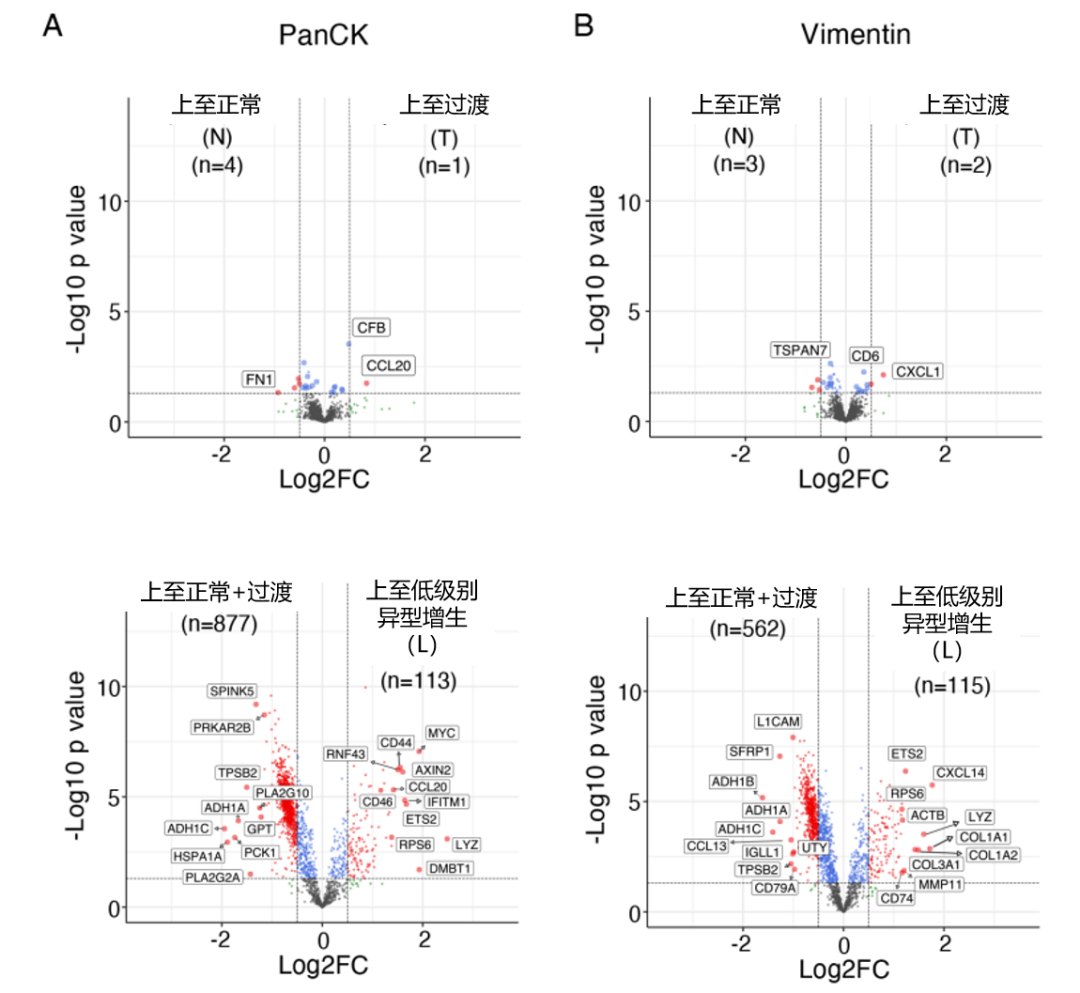
图11:不同组织学之间差异表达的基因火山图
(A:上皮 [PanCK];B:间质 [Vimentin])
此外,研究人员还检测到骨髓细胞浸润增加,巨噬细胞群从促炎 HLA-DR+ CD204- 巨噬细胞转变为 HLA-DR- CD204+ 免疫抑制亚群,从正常组织到癌症,伴随着 CD47/ SIRPα 向巨噬细胞发出“别吃我(Don't eat me)”信号(图12)。
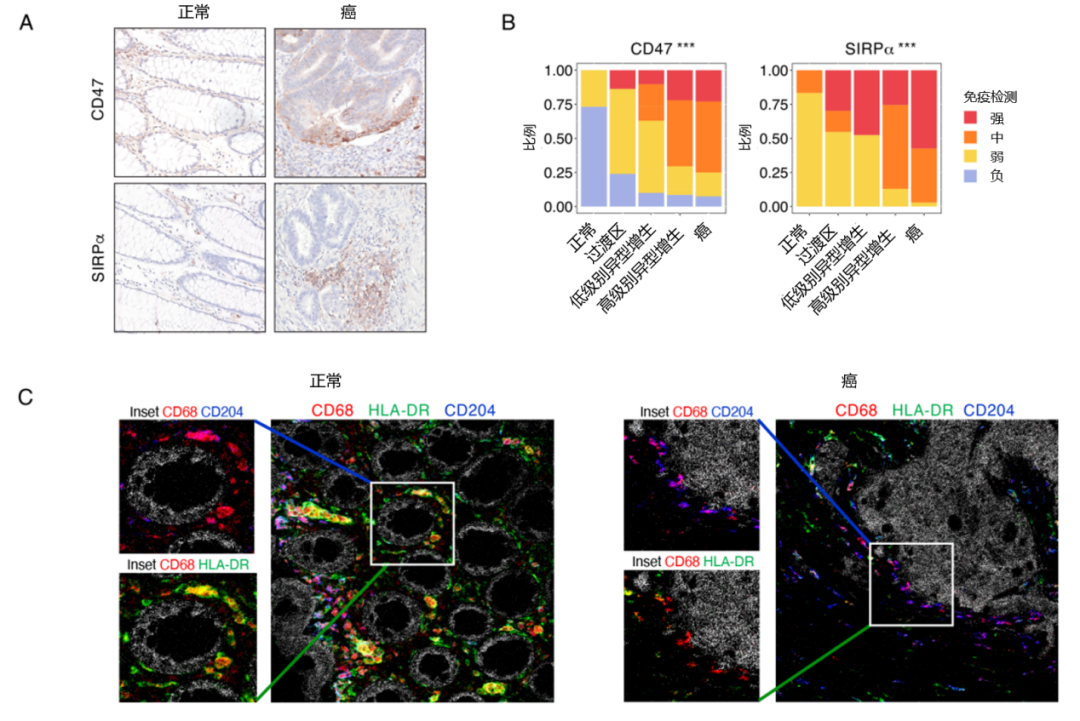
图12:CD47/SIRPα 轴上调和巨噬细胞亚群在从正常组织发展为癌组织过程中的相应变化
(A:IHC 检测 pT1 CRC 样本的不同组织中的 SIRPα 和 CD47;B:18 个 pT1 CRC 样本的独立验证集中 SIRPα 和 CD47 的 IHC 评分;C:pT1 CRC 样本正常区域和癌区域中巨噬细胞亚群流式细胞成像)
总结:空间分析揭示了早期 CRC 肿瘤发生的分子和免疫学景观,并确定了与疾病进展以及可在临床环境中利用的靶向免疫过程密切相关的生物标志物。虽然早期发现和治疗对患者的预后至关重要,但可以进一步改善确诊早期癌症患者的临床管理。目前的研究推进了对 CRC 发病的生物学机制的理解,这是确定支持早期 CRC 患者个性化治疗的生物标志物的第一步,但也是必不可少的一步。
【原文链接】
https://gut.bmj.com/content/early/2022/11/27/gutjnl-2022-3276
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










打卡
44