CIC融合或BCOR重排软组织肉瘤儿童、青少年和年轻成人患者的临床特征和结局
2023-10-26 苏州绘真医学 苏州绘真医学 发表于上海
本研究描述了欧洲CIC、BCOR或YWHAE基因重排软组织肉瘤儿童和年轻患者队列的临床特征、治疗、结局和预后因素。
在一些罕见的未分化小圆细胞肉瘤中,识别了新的分子特征:CIC-DUX4/其他伴侣,BCOR-CCNB3/其他伴侣,YWHAE融合或BCOR-ITD(内部串联重复)。关于这些新的“CIC融合”(CIC融合/ ATXN1::NUTM1)和“BCOR重排”(BCOR融合/ ITD / YWHAE)软组织肉瘤(STS)的研究较少。本研究对欧洲多中心CIC融合和BCOR重排STS年轻患者(0-24岁)进行了回顾性分析。纳入了60例患者,融合状态包括CIC融合(n = 29),ATXN1::NUTM1(n = 2),BCOR::CCNB3(n = 18),BCOR-ITD(n = 7),YWHAE::NUTM2B(n = 3)和MAML::BCOR(n = 1)。原发部位主要为腹部-盆腔(n = 23)和四肢(n = 18)。CIC融合组和BCOR重排组的中位年龄分别为14岁(0.9-23.8)和0.9岁(0.1-19.1)(n = 29;p < 0.001)。IRS分期为I(n = 3),II(n = 7),III(n = 35)和IV(n = 15)。总体而言,42例患者肿瘤较大(>5cm),6例患者淋巴结受累。患者主要接受化疗(n = 57),局部手术(n = 50)和/或放疗(n = 34)。中位随访47.1个月(范围3.4-230),33例(52%)患者发生事件,23例患者死亡。CIC组和BCOR组的3年无事件生存率分别为44.0%(95% CI 28.7–67.5)和41.2%(95% CI 25.4–67.0)(p = 0.97)。3年总生存率分别为46.3%(95% CI 29.6–72.4)和67.1%(95% CI 50.4–89.3;p = 0.24)。儿童患者诊断时常表现为大肿瘤和转移性疾病,尤其是CIC肉瘤。总体结局令人沮丧。需要新的治疗方案。
研究背景
最近在未分类/未分化的小圆细胞肉瘤(USRCS或SRCS)中描述了组织学上类似于尤文氏肉瘤家族(ESFT)肿瘤的圆形/卵形细胞肉瘤新亚群。这些肿瘤以前被称为“尤文样肉瘤”(ELS),在目前的WHO分类中与尤文氏肉瘤区分开来。分子检测揭示了这些肿瘤的遗传特征,现在正在评估这些肿瘤是否可能代表不同的生物学肿瘤亚群。在骨肉瘤中观察到以BCOR::CCNB3基因融合为特征的新亚群。这一发现为肿瘤发生和未来新的治疗考虑提供了新的见解。在一组缺乏典型EWSR1易位的小圆细胞骨肿瘤中描述了罕见的BCOR肉瘤:分析594例肉瘤,只识别了24例BCOR::CCNB3阳性肿瘤。其他“BCOR重排肉瘤”具有BCOR-ITD(内部串联重复)的分子特征。据报道,这些BCOR-ITD肿瘤具有BCOR基因最后一个外显子ITD,表现出侵袭性。位于肾脏的这些肉瘤被描述为肾透明细胞肉瘤(CCSK)。这些肉瘤也被描述为骨和软组织高级别子宫内膜间质肉瘤(HG-ESS),称为USRCS,发生于婴儿为原始黏液样间叶性肿瘤(PMMTI)。CIC::DUX4肉瘤(CDS)或CIC重排肉瘤似乎是另一种具有尤文氏肉瘤(ES)组织学特征的小圆细胞肉瘤的罕见亚组。关于颅外部位,“CIC融合肉瘤”组与“BCOR重排肉瘤”组具有生物学同源性。最近的分析显示,ATXN1肿瘤聚集在CIC肿瘤组,YWHAE融合肿瘤聚集在BCOR肿瘤组。对于BCOR-ITD肿瘤,除了中枢神经系统位置,与其他BCOR重排肉瘤具有共同的转录组学特征外,没有发现影像学、临床和病理特异性。然而,所有这些都被描述为不同于ES的亚群,原发部位包括软组织、内脏和骨(较少)等。
这类肿瘤的治疗选择通常包括化疗(CHT)和局部手术联合放疗(RT),类似于软组织肉瘤或ES的治疗。原发部位为软组织的这类肿瘤的临床描述数据很少。本研究描述了欧洲CIC、BCOR或YWHAE基因重排软组织肉瘤儿童和年轻患者队列的临床特征、治疗、结局和预后因素。
研究结果
患者特征和人口统计
60例患者符合纳入标准。患者在法国(n = 31),意大利(n = 18),德国(n = 10)和瑞士(n = 1)接受治疗。患者和肿瘤特征见表1和2。“CIC融合肉瘤”患者初始诊断的中位年龄为14岁(范围,0.9-23.8),“BCOR重排肉瘤”患者为0.9岁(范围,0-19.1)。原发肿瘤主要位于躯干(53%),特别是腹部/盆腔(38%)。肿瘤通常较大(>5cm,72%),为T2期(60%),只有11%的患者淋巴结受累。58%的患者原发肿瘤在诊断时不可切除(IRS-III,n = 35),25%的患者存在转移性疾病(IRS-IV,n = 15)。转移患者大多为肺转移(n = 9/15)和“CIC融合肉瘤”(n = 13/15)。
表1. CIC/BCOR重排肉瘤患者临床特征
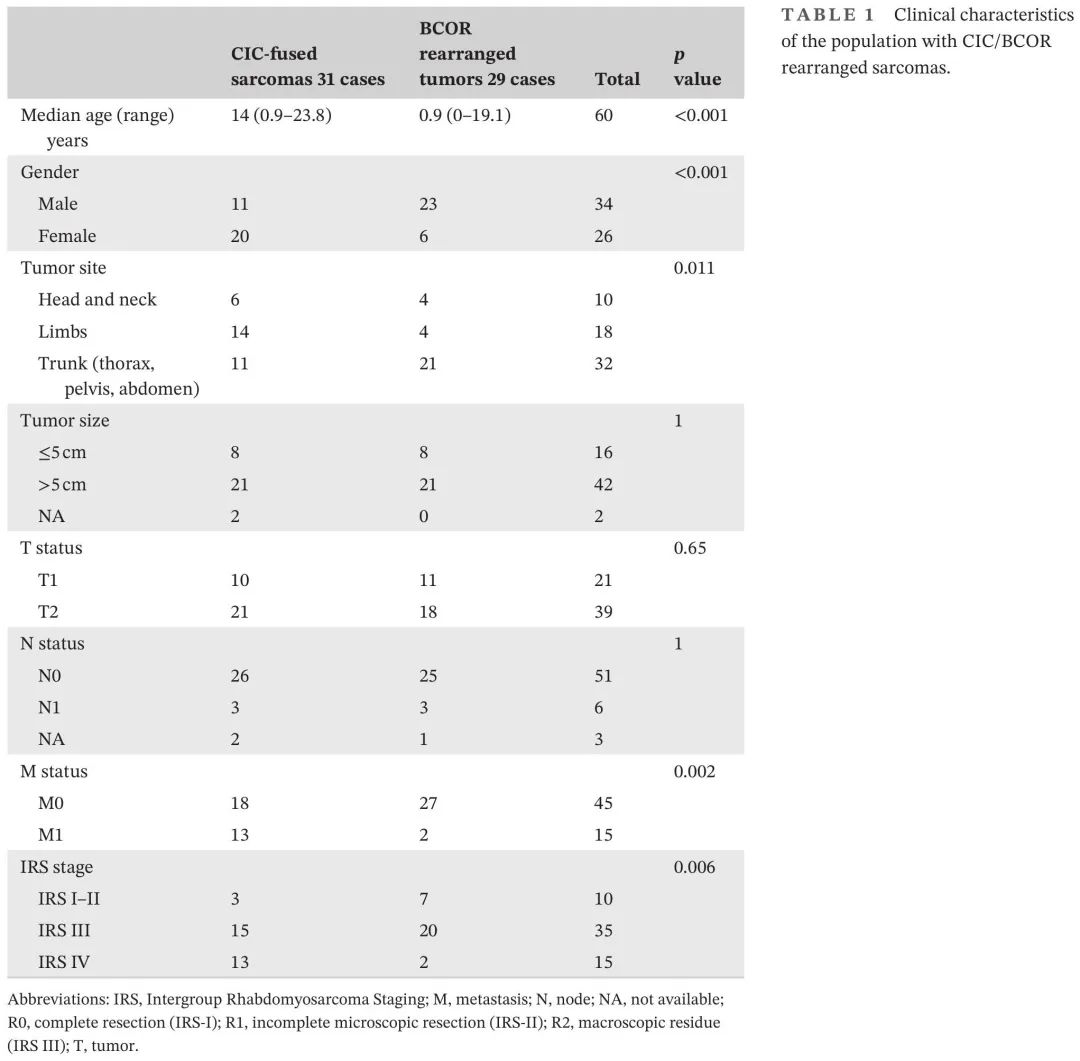
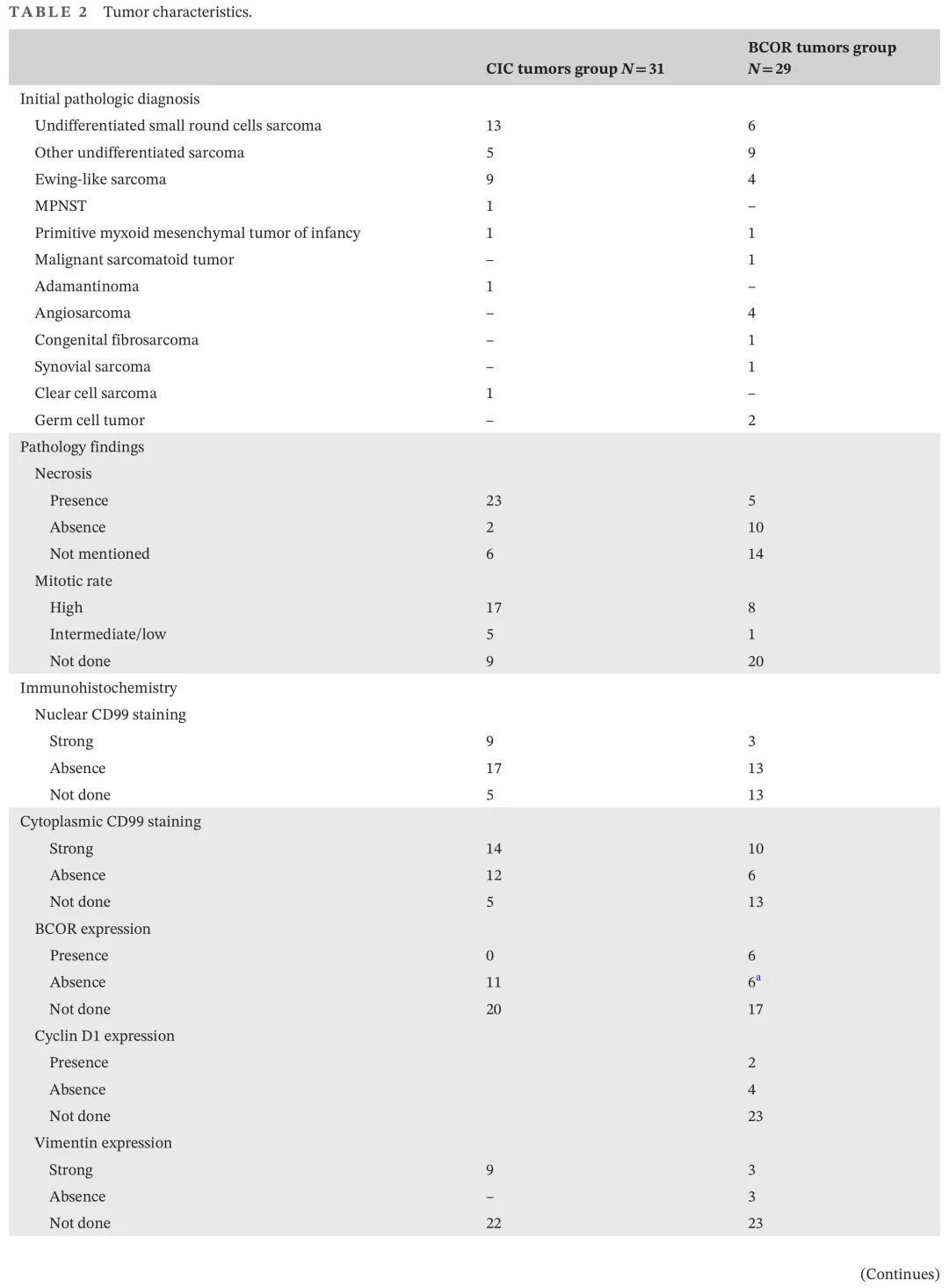
表2. 肿瘤特征
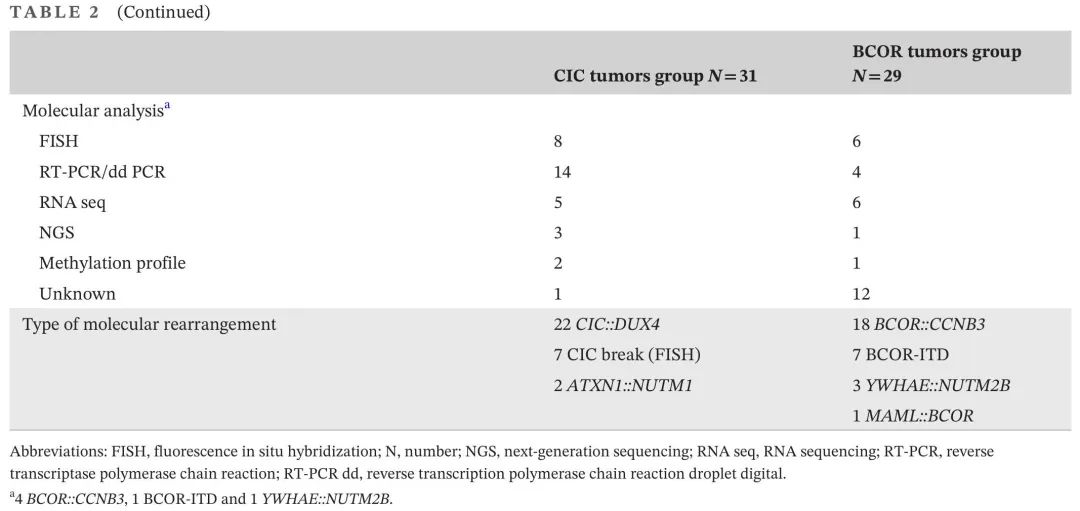
病理诊断主要为USRCS(n=19)、其他未分化型肉瘤(UDS,n=14)、“ELS”(n=13)和各种(n=14)(表2)。总体而言,31例(52%)属于“CIC融合肉瘤”组,29例属于“BCOR重排肉瘤”组。“CIC融合肉瘤”组包括CIC::DUX4(n = 22),CIC断裂(FISH)(n = 7)和ATXN1::NUTM1(n = 2)。“BCOR重排肉瘤”组包括BCOR::CCNB3(n = 18),BCOR-ITD(n = 7),YWHAE::NUTM2B(n = 3)和MAML::BCOR (n = 1;表2)。
治疗
患者接受化疗(n=57),局部手术(n=50)和/或放疗(n=34)(表3)。全身治疗根据STS/RMS方案(IVA/VAC、VAIA、IVADo、Ifo-Doxo;n = 33)或尤文氏肉瘤方案(VDC-IE/VIDE/VAI;n = 19)进行。3例BCOR重排局限性肿瘤年轻患者(<3岁)未进行CHT(2例IRS-II未进行任何其他治疗,1例IRS-III进行辅助放疗)。大多数患者接受基于烷化剂的CHT:异环磷酰胺(n = 27)或环磷酰胺(n = 2)或两者都有(n = 15)。经常加入基于蒽环类药物的方案(80%),特别是“CIC融合肉瘤”。其他HD CHT,白消安和美法仑(n = 4)或未指明方案(n = 1),用于IRS-III(n = 4)和IRS-IV(n = 1)。接受环磷酰胺/长春瑞滨(n = 5)或口服曲磷胺/伊达比星/依托泊苷(n = 1)维持治疗(未指明方案,n = 2)。局部原发肿瘤切除术实施于诊断时(n = 20),延迟至CHT±放疗后(n = 28)或两者都有(n = 2)。大多数 [22/35例(63%)] 初始未切除/不可切除肿瘤患者(IRS III组)获益于延迟R0-R1切除。
表3. 治疗
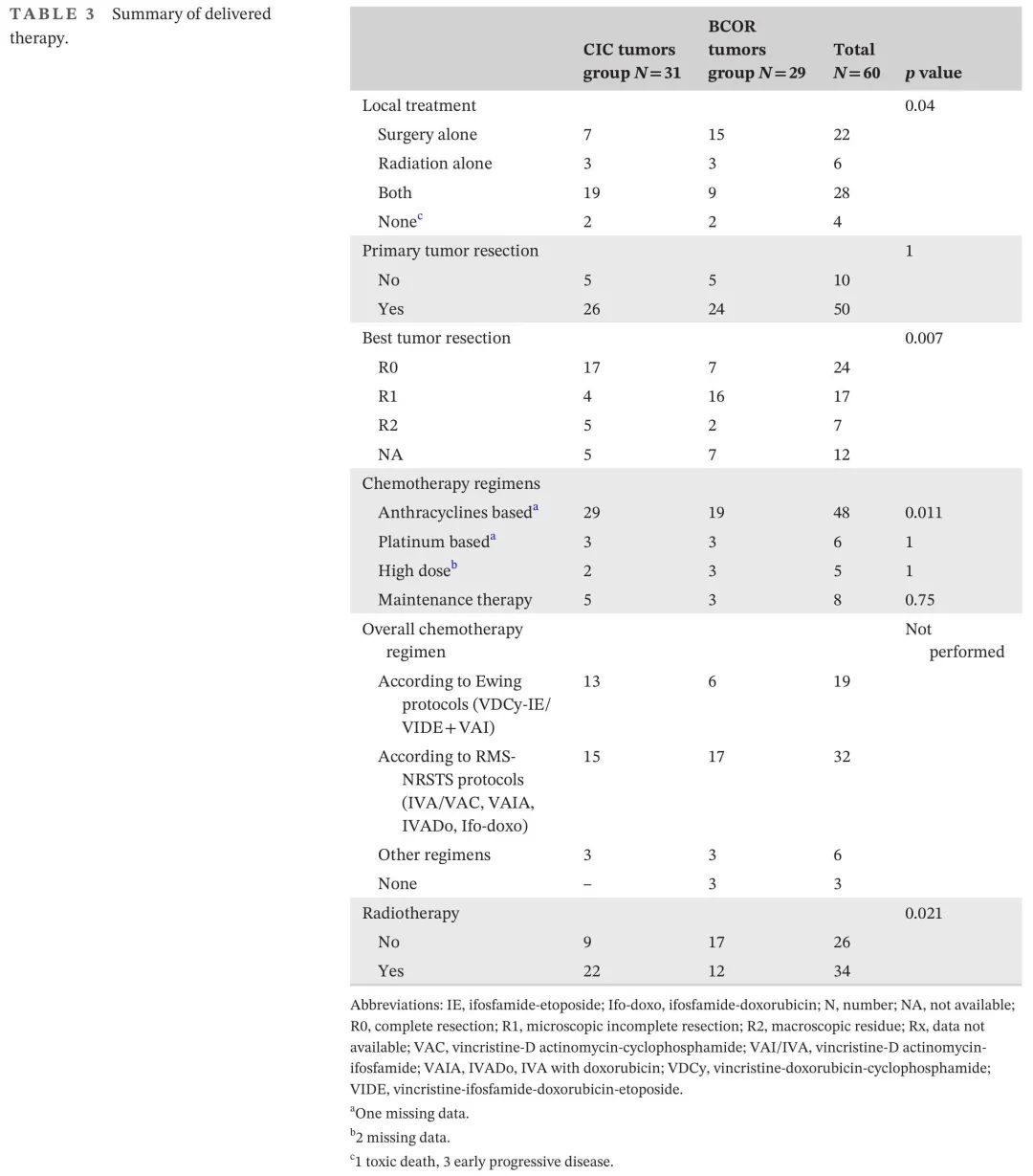
原发肿瘤RT实施于(n = 34):局限性疾病(n = 26)和转移性疾病(n = 8),在最佳结果R0切除(n = 17),R1切除(n = 6)和R2切除(n = 3)(切除详细信息不可及[n = 2])后,或仅RT(n = 6)。原发肿瘤中位放疗剂量为54 Gy(范围,42-60)。转移部位放疗剂量为肺转移灶18Gy(n = 6;数据缺失,n = 2)。CIC肉瘤患者更可能接受初始手术和放疗,而BCOR肿瘤更常接受仅手术(p = 0.04,表3)。
分子亚群特征
在31例“CIC融合肉瘤”患者队列中,中位年龄为14岁(范围0.9-23.8),13/31例患者存在移性疾病(42%,表1)。大多数患者没有区域淋巴结受累(84%),女性居多(65%),原发肿瘤通常位于四肢(45%)。最大肿瘤通常>5cm(68%),广泛(T2,68%)。相比之下,“BCOR重排肉瘤”组中的29例患者较年轻(p < 0.001),中位年龄为0.9岁(范围,0.1-19.1),其中BCOR::CCNB3(n = 18)的中位年龄为4岁(范围,0.1-19.1),BCOR-ITD(n = 7)为1岁(范围,0.3-18.3)。27/29例患者(93%,p = 0.002)为局限性疾病,只有2例YWHAE::NUTM2B 融合肿瘤存在转移或淋巴结受累。大多数患者为男性(79%,p < 0.001),原发部位多为腹部/盆腔(72%,p = 0.011)。肿瘤也通常较大(>5cm;72%),多为T2期(62%)(表1)。
与“BCOR重排肉瘤”患者相比,更高比例的“CIC融合肉瘤”患者接受包括蒽环类药物在内的CHT(94% vs. 66%;p = 0.01),手术切除程度较高(R0 vs. R1/R2;65.4% vs. 31.8%,p = 0.007),接受RT(71% vs. 41%,p = 0.02)(表3)。
结局
整个队列的中位随访时间为47.1个月(范围,0.3–229.9),CI 95% [30.8–66.0]。发生32起事件,中位8.2个月后(范围,0.5-115):局部进展(n = 5),局部复发(n = 8),转移性进展(n = 10),转移性复发(n = 7)和联合进展(n = 2)。所有死亡都是由于肿瘤进展,1例患者死亡与化疗相关。在45例初始局限性疾病患者中,30例(67%)在最近一次随访时存活:CR(n = 22),PR(n = 3),治疗中(n = 2)和PD(n = 1)(肿瘤状态未指明,n = 2)。在15例转移性疾病患者中,7例(47%)仍然存活:CR(n = 5),PR(n = 1)和治疗中(n = 1)。总体而言,“CIC融合肉瘤”组和“BCOR重排肉瘤”组的3年无事件生存率(EFS)分别为44.0%(95% CI 28.7-67.5)和41.2%(95% CI 25.4-67.0)(p = 0.97)。3年OS分别为46.3%(95% CI 29.6–72.4)和67.1%(95% CI 50.4–89.3;p = 0.24)。两组之间的3年EFS和OS没有显著差异(图1和2)。
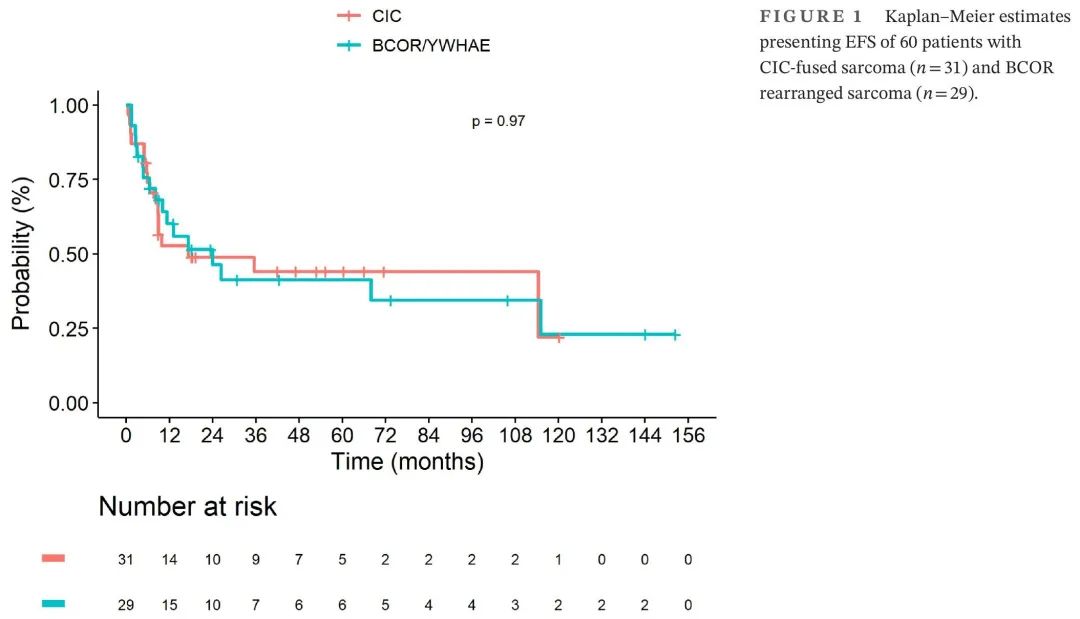
图1. 60例CIC融合肉瘤(n = 31)和BCOR重排肉瘤(n = 29)患者的EFS Kaplan–Meier估计
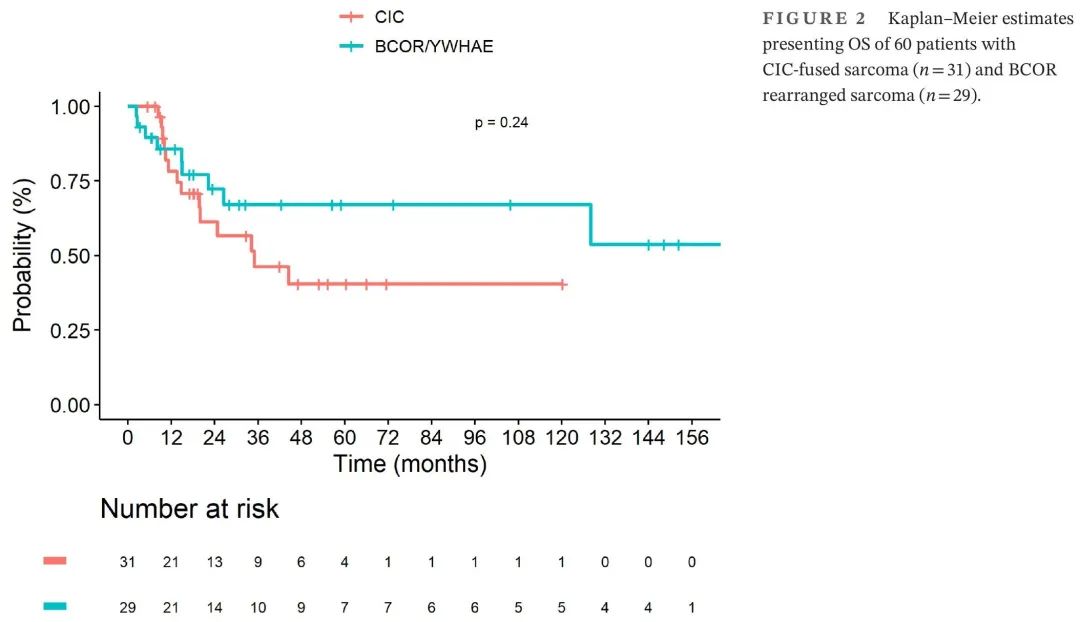
图2. 60例CIC融合肉瘤(n = 31)和BCOR重排肉瘤(n = 29)患者的OS Kaplan–Meier估计
统计分析和预后因素
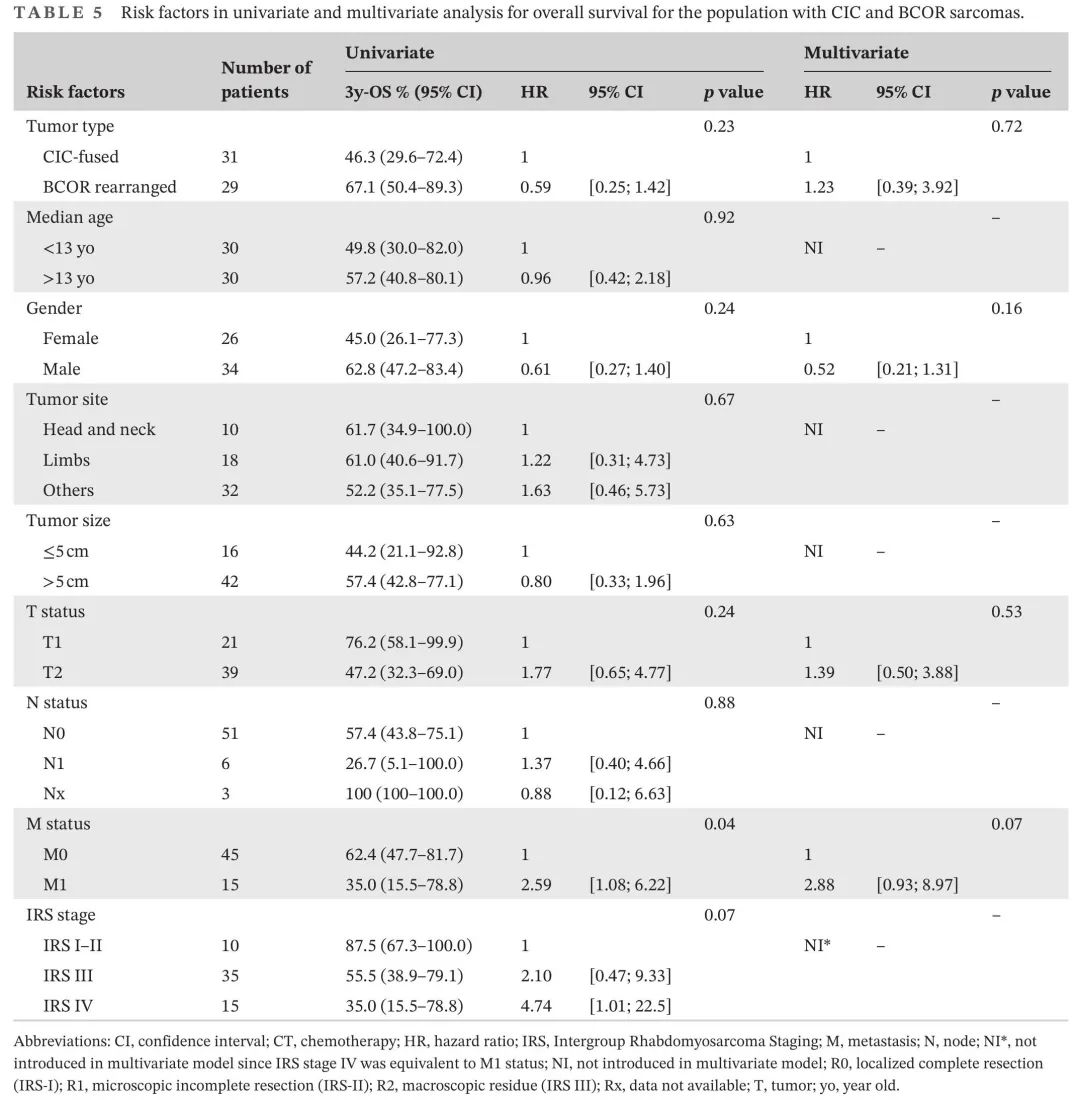
关于临床特征,单变量和多变量分析显示,年龄>13岁是唯一与较好的EFS显著相关的临床因素(表4)。值得注意的是,这些风险因素仅存在于BCOR/YWHA肿瘤(p = 0.012),不存在于CIC肉瘤(p = 0.84)。在单变量和多变量分析中,转移的存在是唯一与较差的OS显著相关的因素(表5)。在单变量分析中男性显示出显著较好的OS,但在调整其他风险因素后没有。
表4. CIC和BCOR肉瘤患者EFS单变量和多变量分析中的风险因素
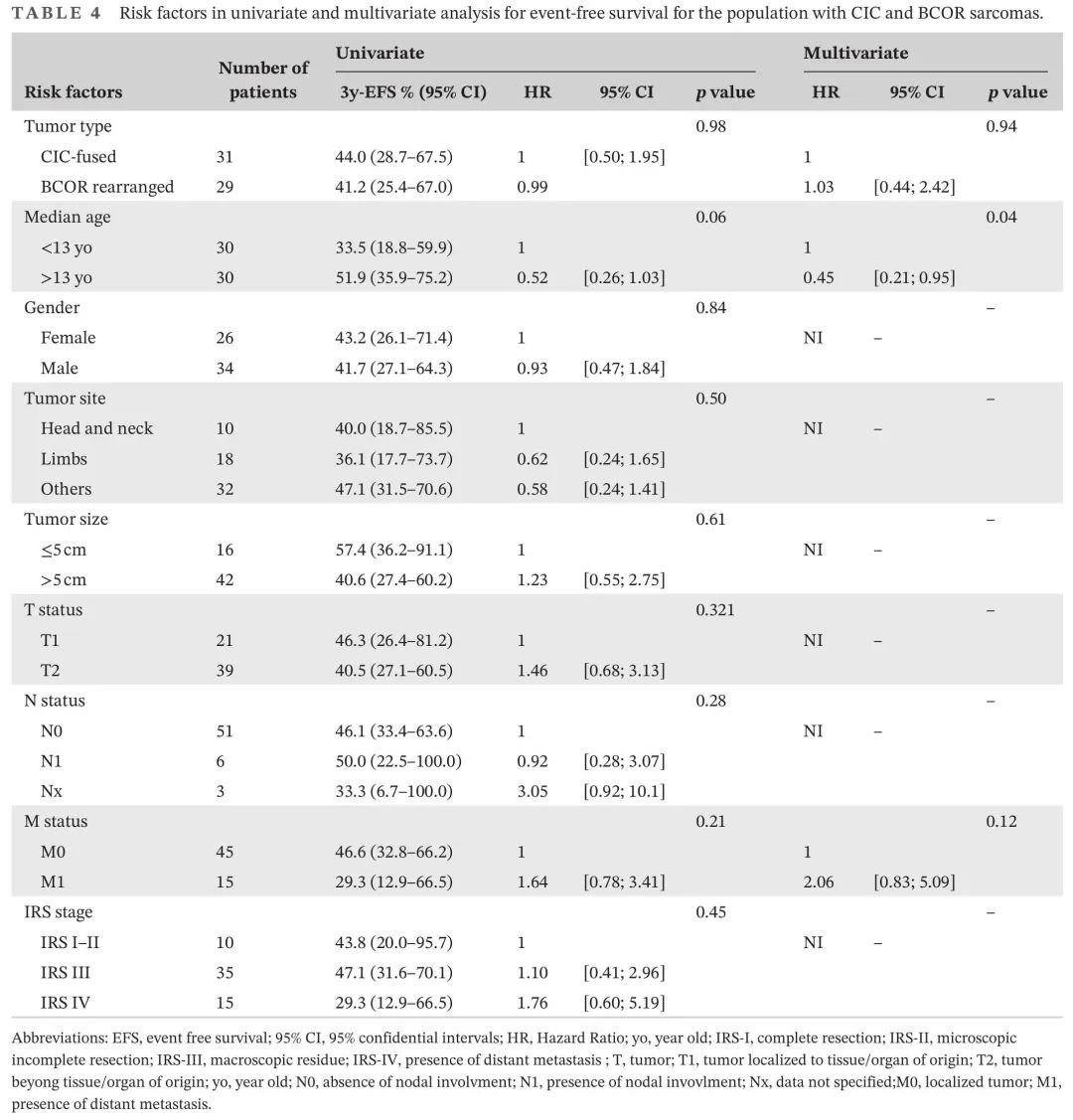
表5. CIC和BCOR肉瘤患者OS单变量和多变量分析中的风险因素
讨 论
本研究首次报告了新定义的软组织肉瘤分子亚组“CIC融合肉瘤”和“BCOR重排肉瘤”欧洲年轻患者队列的临床数据。
在115例患者中描述了“CIC融合肉瘤”,常见于软组织肉瘤(86%),主要发生于成人(中位年龄32岁)。该分析包括儿童、青少年和年轻成人的数据。年轻成人(AYA)的定义各不相同,主要包括24岁以下的患者。然而,毫无疑问,需要与成人肿瘤学家合作纳入年龄较大的患者的数据,来总结更大队列的情况,这些数据并不反映总体诊断年龄。
在本研究中,“CIC融合”STS主要位于躯干,诊断时经常为转移性疾病。相比之下,“BCOR重排肉瘤”多发生于骨(64%)和儿童患者(76%):BCOR::CCNB在青少年中更常见,而BCOR-ITD在婴儿中更常见。本研究无法表明与所有部位的数据相比,BCOR::CCNB相比其他分子变异(如BCOR-ITD或YWHAE变异)的发生年龄有任何差异。
在本研究中,与“CIC融合”STS患者相比,BCOR重排队列中,较多患者有局限性肿瘤,位于四肢,诊断年龄显著较小,证实了包括骨位置在内的研究结果。有趣的是,我们发现,年龄是EFS的重要因素,特别是对于BCOR/YWHA肿瘤,但不是生物学实体本身。造成这种差异的确切原因尚不明确。然而,由于这一发现仅存在于BCOR/YWHA肉瘤,一种可能是,在某种程度上,治疗差异可能影响患者结局。较多BCOR肿瘤患者较年轻,可能接受不同的治疗(如较少的放疗),这或许可以解释这种差异。
这些不同的分子变异似乎对预后有影响。研究显示,BCOR变异肿瘤患者的总体预后较差。BCOR::CCNB3融合肿瘤的5年OS为68%,而BCOR-ITD或ZC3H7B::BCOR肿瘤患者的生存率较低,超过50%的患者死于疾病复发。在我们的患者中,诊断时“CIC融合肉瘤”中IRS IV肿瘤数量显著更高,在“BCOR重排肉瘤”中只有两例。“BCOR重排肉瘤”组的EFS低于“CIC融合肉瘤”组。这提示,由于“BCOR重排肉瘤”组的年龄较小,可能未进行有效治疗,这可能也解释了为什么复发时挽救率较高,鉴于与“CIC融合肉瘤”组相比,总生存期较优。
我们推荐开发横纹肌肉瘤影像学指南,因为CIC和BCOR肉瘤需要特定的指南。疾病的初始程度和患者诊断时的年龄可能是治疗异质的原因。这些患者的结局不令人满意,3年OS分别为46.3%和67.1%,尽管没有统计学意义(p = 0.24)。这些数据与已发表的包括骨原发患者的数据相关:“CIC 融合肉瘤”的5年OS为43%,“BCOR 重排肉瘤”为72%。与其他STS一样,转移状态是OS的明确预后因素。
我们能够提供有关CHT和局部治疗的详细数据:在欧洲,这两个分子亚组均更可能接受(非)横纹肌肉瘤STS方案,而不是尤文氏肉瘤方案。然而,这些方案中的主要药物是相似的,主要区别在于CHT疗程的总数。多模式策略似乎很重要,但需要更大的队列来评估每种疗法对此类患者的价值。
这些数据的主要缺点包括其回顾性性质,来自不同的数据库或中心。无法评估检测时间。由于包括了在2015年之前诊断的患者,有患者的分子诊断在初始组织学诊断后几年做出。这些生物学上不同的癌症极为罕见。考虑来自欧洲国家德国、瑞士、奥地利、波兰、瑞典和芬兰的CWS患者,在247例组织学诊断为USRCC/UDS/ES的STS患者中,11例CIC融合/BCOR重排STS在欧洲CWS研究和SoTiSaR中登记。另外,我们无法报告所有中心的骨、肾和中枢神经系统“CIC融合肉瘤”和“BCOR重排肉瘤”患者人数。为了了解这些生物学上不同的癌症的发生率和临床数据,有必要进行更大规模的国际回顾性研究,包括骨,肾脏和CNS研究和登记。
毫无疑问,需要基于体细胞遗传背景的国际通用策略,并且需要建立考虑这些亚群总体不良预后的新的国际风险分层。
这些数据还强调,对于具有尤文氏肉瘤特征、不具有典型EWS融合转录本的肿瘤,需要进行额外的分子检测。应结合肿瘤基因组测序和基于基因型的亚组,帮助了解不同的临床结果。最后,需要开发新的治疗方案。其中一些似乎很有希望,在这些罕见疾病中,国际合作,开发包括新治疗策略在内的试验,至关重要。最近,Palmirini等人使用RNA seq,在CIC重排肉瘤中应用了537个失调基因的独特特征,发现与ES相比,CIC::DUX4转录谱在DUSP4,ETV1/4,IGF2,IGF2BP和PTX1/3中富集,这些基因与伊立替康,蛋白酶体抑制剂(硼替佐米和MG262)和组蛋白去乙酰化酶抑制剂(scriptaid和伏立诺他)的活性相关。未来需要对骨和软组织肉瘤中的这些罕见疾病患者进行综合分析,以更好地比较不同的治疗方案,确定预后因素,制定新的治疗策略。
参考文献:
Sparber-Sauer M, Corradini N, Affinita MC, Milano GM, Pierron G, Carton M, Tirode F, Pissaloux D, Alaggio R, Vokuhl C, Bisogno G, Berlanga P, Ferrari A, Orbach D. Clinical characteristics and outcomes for children, adolescents and young adults with "CIC-fused" or "BCOR-rearranged" soft tissue sarcomas: A multi-institutional European retrospective analysis. Cancer Med. 2023 Jul;12(13):14346-14359. doi: 10.1002/cam4.6113. Epub 2023 May 22. PMID: 37212486; PMCID: PMC10358194.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言