Cell Genomics:周钢桥/李元丰/张学军/贺福初团队鉴定肝癌“合成致死”新靶点NRDE2
2024-05-05 iNature iNature 发表于上海
该研究首次系统描绘了中国人群肝癌的罕见遗传变异图谱,揭示罕见遗传变异与肝癌的发生风险密切相关,并鉴定了多个新的肝癌易感基因。
原发性肝细胞癌(Hepatocellular carcinoma, HCC;简称肝癌)是最常见的恶性肿瘤之一,其全球年发病率位居所有恶性肿瘤的第五位、致死率高居第三位。肝癌的发生发展是环境因素和遗传因素共同作用的结果。在我国,大约80%的肝癌与乙型肝炎病毒(Hepatitis B virus, HBV)感染相关。但是,HBV慢性感染者中仅有少部分个体最终罹患肝癌;同时,肝癌的发生具有家族聚集倾向,这些均提示遗传因素在肝癌的发生发展中发挥重要作用。军事科学院军事医学研究院周钢桥研究员团队长期致力于中国人群HBV相关肝癌的遗传易感基因研究,2010年以来,他们基于基因组的常见遗传变异标记开展了系列研究,已在Nature Genetics、Clinical Cancer Research和Gastroenterology等杂志相继报道了染色体1p36.22、7q21.13和15q13.3等是肝癌的易感基因区域,并揭示了位于这些区域的易感基因KIF1Bβ、CDK14和SNORA18L5等【1-3】。但是这些基于常见遗传变异标记发现的易感基因仍不足以解释肝癌全部的遗传度。近年来,越来越多的研究提示基因组中的罕见遗传变异也可能是包括肝癌在内的复杂疾病的重要遗传学病因。然而,迄今尚无系统鉴定肝癌相关罕见遗传变异的研究报道。
2024年5月1日,周钢桥团队联合安徽医科大学张学军教授团队和军事医学研究院贺福初院士团队在Cell子刊Cell Genomics 杂志上发表了题为“NRDE2 deficiency impairs homologous recombination repair and sensitizes hepatocellular carcinoma to PARP inhibitors”的长篇研究论文,首次系统描绘了中国人群肝癌的罕见遗传变异图谱,揭示罕见遗传变异与肝癌的发生风险密切相关,并鉴定了多个新的肝癌易感基因。该研究进一步以其中的NRDE2(Necessary For RNA Interference, Domain Containing)基因为例,揭示其可通过促进蛋白激酶CK2复合体的组装和活性,促进下游底物MDC1的磷酸化,进而激活同源重组(Homologous recombination, HR)修复通路介导的DNA双链断裂修复,最终在肝癌的发生发展中发挥抑癌基因的功能。而NRDE2基因中的罕见遗传变异可导致其HR修复功能丧失,并显著增强肝癌对PARP抑制剂的敏感性,因而提示NRDE2基因是一个新的肿瘤“合成致死(Synthetic lethal effect)”靶点。

图1:论文首页截图
研究团队首先在2,750例HBV相关肝癌患者和4,153例对照个体中开展了全外显子组测序,鉴定了共约20万个罕见遗传变异位点。进一步采用“基于单个位点”和“基于基因负荷”的全基因组遗传关联分析策略,系统比较了肝癌病例组和对照组人群间罕见遗传变异的差异,最终发现一系列基因上的罕见遗传变异与肝癌的发生风险显著相关,提示这些基因是肝癌的潜在的易感基因。尤其是,其中的NRDE2基因上的错义遗传变异p.N377I与肝癌发生风险的相关性最为显著,携带该变异的个体罹患肝癌的风险可增加约15倍,患病年龄可提早约6年。
NRDE2基因最早在线虫中被发现,其主要功能是参与RNA干扰所致的基因沉默。近期有研究报道,在人类细胞中NRDE2可参与调控RNA降解和RNA可变剪接。然而,NRDE2在包括肝癌在内的肿瘤的发生发展中的生物学功能及分子机制一直未有报道。在本研究中,研究团队揭示了NRDE2具有抑制人类肝癌细胞生长和迁移的功能。进一步研究发现,NRDE2可作为支架蛋白与酪蛋白激酶2(Casein kinase 2, CK2)的三个亚基CK2α、CK2α’和CK2β直接结合,促进CK2复合体的组装和全酶活性,从而促进下游底物MDC1的磷酸化,进而招募MRE11-RAD50-NBS1(MRN复合体)至DNA双链断裂处,激活HR通路介导的DNA损伤修复功能。而位于NRDE2蛋白TPR结构域上的罕见遗传变异p.N377I可导致上述系列功能丧失,提示该变异发挥“功能缺失(loss-of-function)”效应。
已知HR修复通路和多聚腺苷二磷酸核糖聚合酶(Poly(ADP-ribose) polymerase, PARP)修复通路分别参与基因组DNA的双链和单链损伤修复,这种“双保险组合”可有效保证正常细胞的基因组DNA复制的准确性。当对HR修复通路缺陷(一个广为人知的例子是BRCA1/2基因突变)的肿瘤细胞使用特异性靶向PARP的抑制剂时,将导致这种“双保险组合”功能的丧失,从而产生合成致死效应杀死肿瘤细胞【4】。基于该原理,目前已有多款PARP抑制剂被官方批准应用于乳腺癌、卵巢癌、前列腺癌和胰腺癌等肿瘤的治疗。除BRCA1/2基因外,其它HR修复相关基因的突变也会产生类似BRCA1/2突变的肿瘤药物响应表型,该现象被称为“BRCAness”。具有BRCAness特征的肿瘤患者,其肿瘤表现为HR修复通路缺陷,这些患者将有望从PARP抑制剂治疗中获益。因此,寻找新的BRCAness标志物,对扩大PARP抑制剂获益人群以及实现肿瘤的“精准治疗”具有重要意义【5】。
鉴于NRDE2参与HR修复功能,研究团队进一步探索了肿瘤细胞中NRDE2基因缺陷与PARP抑制剂潜在的合成致死效应。结果发现,在肝癌细胞系和肝癌病人来源的肿瘤异种移植物(Patient-derived tumor xenograft, PDX)模型中,NRDE2基因缺陷(包括表达下调和功能失活突变)可显著增强肿瘤细胞对PARP抑制剂奥拉帕尼的敏感性。进一步还发现,NRDE2缺陷可使肿瘤细胞对奥拉帕尼与铂类化疗药物奥沙利铂的联合用药更为敏感。这些结果因而确证了肝癌细胞中NRDE2基因缺陷与PARP抑制剂的合成致死效应。
总之,本研究采用基于罕见遗传变异的遗传分析策略,鉴定了新的肝癌易感基因NRDE2,揭示其能够促进HR修复通路介导的DNA损伤修复,并发现其缺陷可与PARP抑制剂形成肿瘤细胞的合成致死效应,提示NRDE2是肝癌“合成致死”新靶点,有望为肝癌的“精准治疗”提供新的策略和途径。上述发现有待在未来的临床试验中确证。
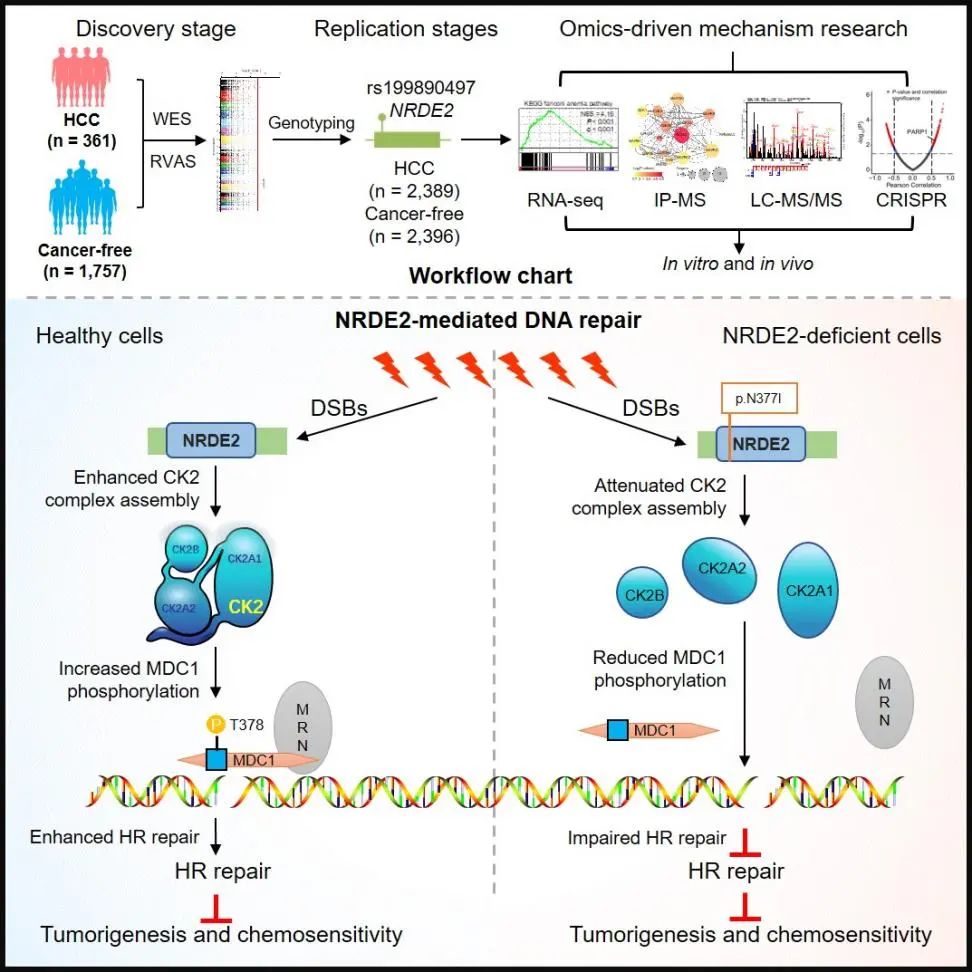
图2:本研究的总体思路和主要结果
军事医学研究院辐射医学研究所的周钢桥研究员、李元丰副研究员、安徽医科大学第一附属医院的张学军教授、军事医学研究院生命组学研究所的贺福初院士为本论文的共同通讯作者;军事医学研究院辐射医学研究所的王亚会博士、刘信燚助理研究员、王翠玲硕士和北京中日友好医院的左先波教授为本论文的共同第一作者。论文所列的其它作者也分别对本项研究做出了重要贡献。
原文链接:
https://www.cell.com/cell-genomics/fulltext/S2666-979X(24)00106-X
参考文献:
1. Zhang, H., et al. (2010). Genome-wide association study identifies 1p36.22 as a new susceptibility locus for hepatocellular carcinoma in chronic hepatitis B virus carriers. Nat. Genet. 42, 755-758.
2. Li, Y. et al. (2018) Genome-wide association study identifies a new locus at 7q21.13 associated with hepatitis B virus-related hepatocellular carcinoma. Clinical Cancer Research 24, 906-915.
3. Cao, P. et al. (2018). Germline Duplication of SNORA18L5 Increases Risk for HBV-related Hepatocellular Carcinoma by Altering Localization of Ribosomal Proteins and Decreasing Levels of p53. Gastroenterology 155, 542-556.
4. Gogola, E. et al. (2019). Selective Loss of PARG Restores PARylation and Counteracts PARP Inhibitor-Mediated Synthetic Lethality. Cancer Cell 35, 950-952.
5. Pilie, P. et al. (2019). State-of-the-art strategies for targeting the DNA damage response in cancer. Nat Rev Clin Oncol 16, 81-104.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#肝癌# #NRDE2#
10