Lancet Haematol:信迪利单抗联合P-GEMOX一线治疗晚期ENKTL的多中心、单臂、2期研究
2024-04-05 聊聊血液 聊聊血液 发表于威斯康星
鉴于PD-1联合化疗治疗一线ENKTL的研究较少,国内学者开展了一项多中心2期研究,旨在评估信迪利单抗联合P-GEMOX(培门冬酶、吉西他滨和奥沙利铂)一线治疗晚期ENKTL的安全性和疗效。
信迪利单抗联合P-GEMOX
结外NK/T细胞淋巴瘤(ENKTL)组织高表达PD-L1,PD-1抑制剂信迪利单抗对复发难治性结外鼻型NK/T细胞淋巴有效。鉴于PD-1联合化疗治疗一线ENKTL的研究较少,国内学者开展了一项多中心2期研究,旨在评估信迪利单抗联合P-GEMOX(培门冬酶、吉西他滨和奥沙利铂)一线治疗晚期ENKTL的安全性和疗效。结果近日发表于《Lancet Haematology》,通讯作者为中山大学肿瘤防治中心蔡清清教授和中山大学孙逸仙纪念医院钟文龙教授,共同第一作者为中山大学肿瘤防治中心田小朋教授、蔡君教授、夏奕教授、张宇辰教授和北京同仁医院王亮教授。

研究方法
该多中心、单臂、2期研究在中国3家中心(中山大学肿瘤防治中心、北京同仁医院、湖南省肿瘤医院)开展。纳入年龄18~75岁、经病理证实的初治晚期(Ann Arbor 3-4期)ENKTL、ECOG PS 评分为0~2分的患者。患者接受静脉注射信迪利单抗(第1天200mg)、肌肉注射培门冬酶(第1天2000 U/m²)、静脉注射吉西他滨(第1天和第8天1 g/m²)和静脉注射奥沙利铂(第1天130 mg/m²)治疗,3周/周期,共6个周期,之后每3周接受1次静脉注射信迪利单抗(200mg)维持治疗2年,或直至疾病进展或出现不可接受的毒性。主要终点为意向治疗(ITT)人群的完全缓解(CR)率(Lugano 2014标准),次要终点为总缓解率(ORR)、无进展生存期(PFS)、无病生存期(DFS)和总生存期(OS)。该研究已完成入组,仍在随访中。
研究结果
共筛选41例患者并成功入组34例(83%),见图1。
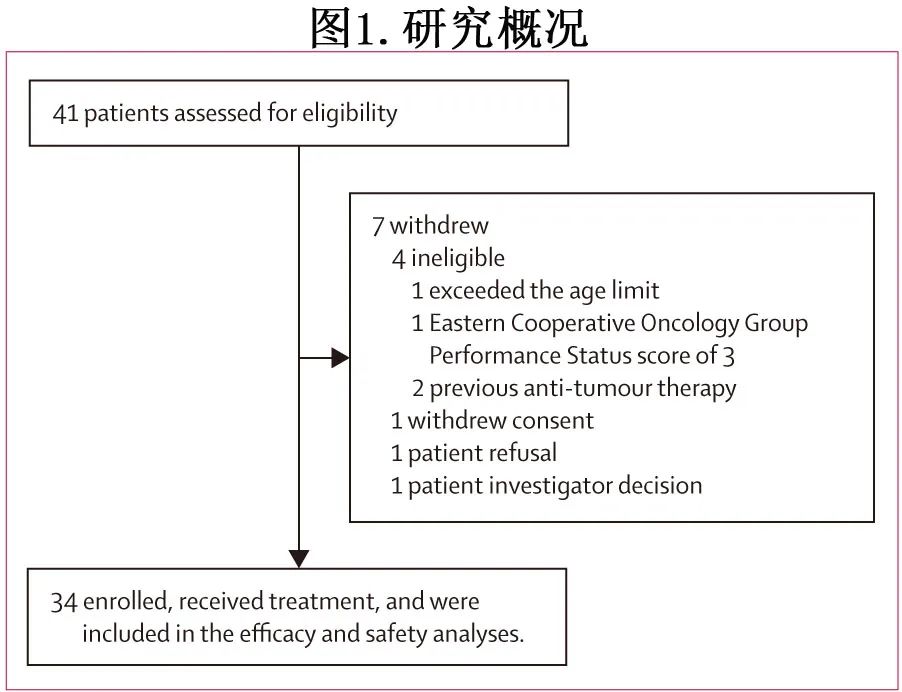
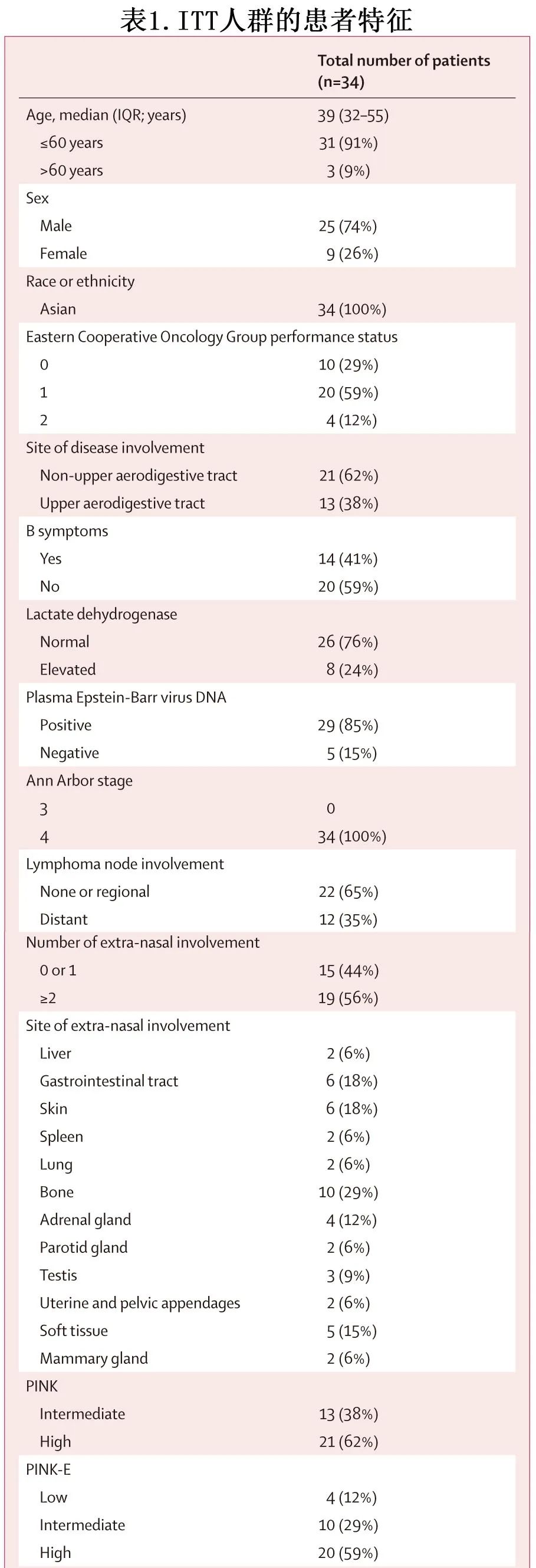
纳入的所有34例患者均启动治疗方案并纳入分析。中位年龄39岁,所有患者均为Ann Arbor 4期,25例(74%)为男性,9例[26%]为女性(表1)。3例患者发生违背方案:2例患者出现治疗延迟,1例患者出现随访延迟。
数据截止时,中位治疗持续时间为16个月。34例患者中有32例(94%)完成计划的6个周期诱导化疗,而2例(6%)患者因疾病进展停止治疗:1例患者在4个周期诱导化疗后,1例患者在5个周期诱导化疗后。患者接受中位13个周期的信迪利单抗维持治疗。
数据截止时,34例患者中的7例(21%)已完成计划的治疗,而16例(47%)患者的治疗仍在进行中。1例患者因治疗相关不良事件停止治疗。此外,34例患者中有10例(29%)因疾病进展停止治疗,7例(21%)继续接受二线治疗,2例(6%)继续接受三线治疗(图2)。
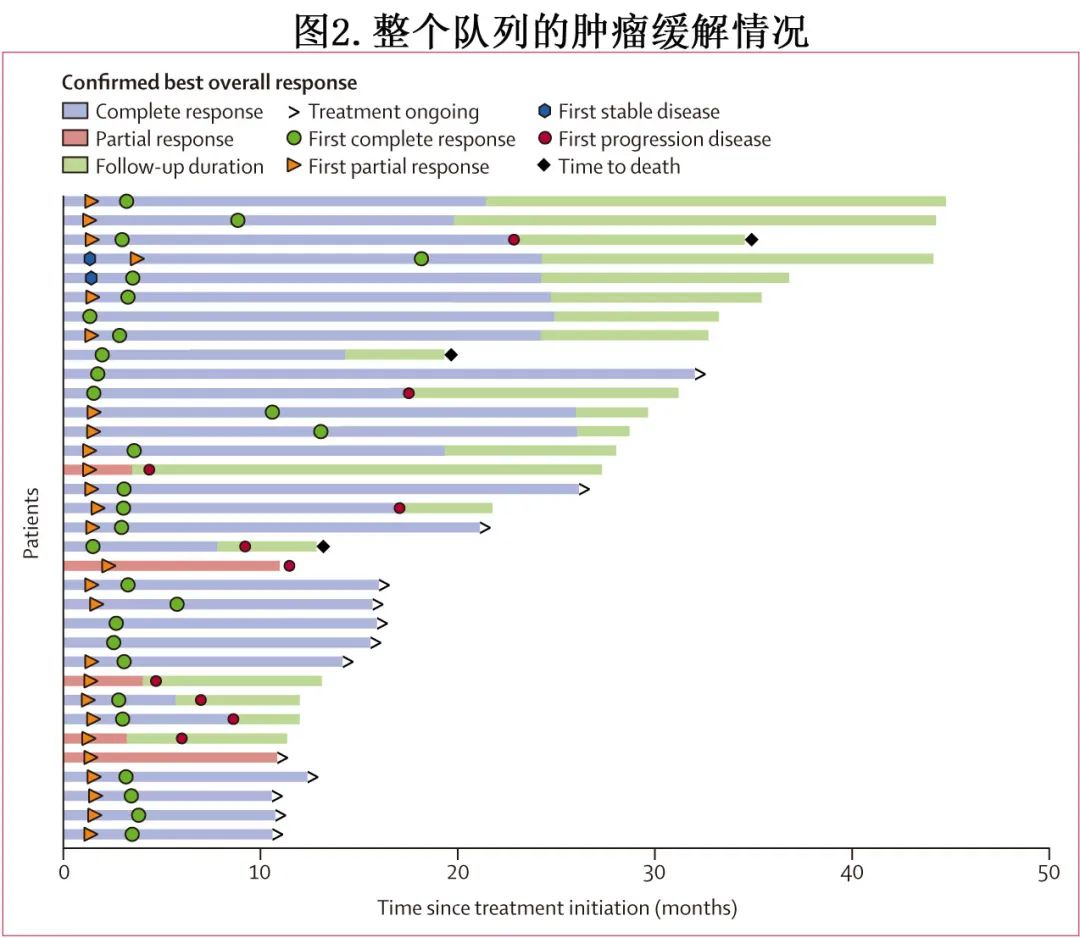
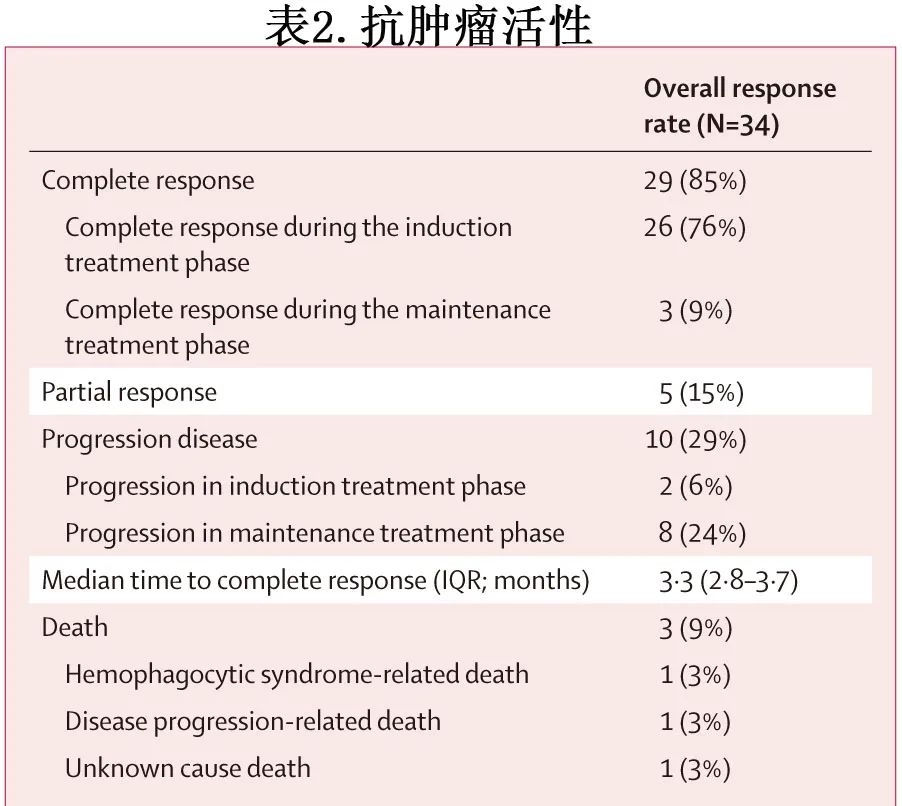
34例患者均进行疗效评估,其中29例(85%)患者的最佳总体缓解为CR,高于预设的完全缓解率(62%),从而达到研究的主要终点;诱导期和维持治疗期分别有26例(76%)和3例(9%)达到CR(图2,表2)。5例(15%)获得PR,ORR为100%(34/34)。至完全缓解的中位时间为3.2个月,至部分缓解的中位时间为1.5个月。
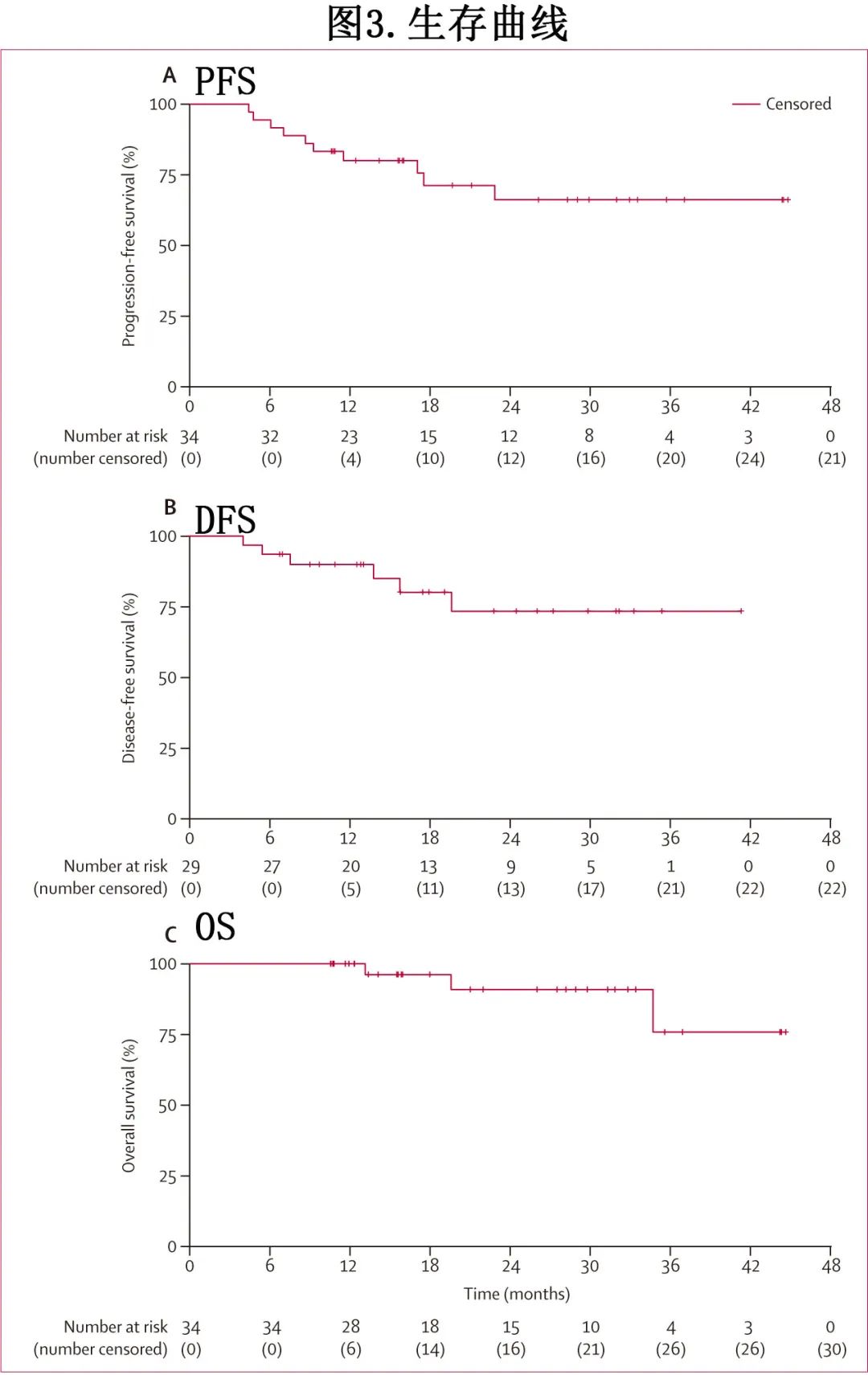
中位随访21个月,34例患者中有10例(29%)出现疾病进展,3例(9%)死亡。中位PFS、DFS和总生存期未达到(图3);12个月PFS为79%, 24个月PFS为64%,12个月DFS为89%,24个月DFS为72%。34例患者中有3例(9%)死亡,12个月、24个月和36个月的OS率分别为100%、91%和76%(图3)。达到CR的患者的PFS显著优于未达到CR的患者(CR解患者vs未CR患者的PFS:24个月PFS率73% vs 6个月PFS率40%;HR=15,p<0.0001)。
在安全性评估期间,所有患者均发生了至少1起治疗相关不良事件(表3)。
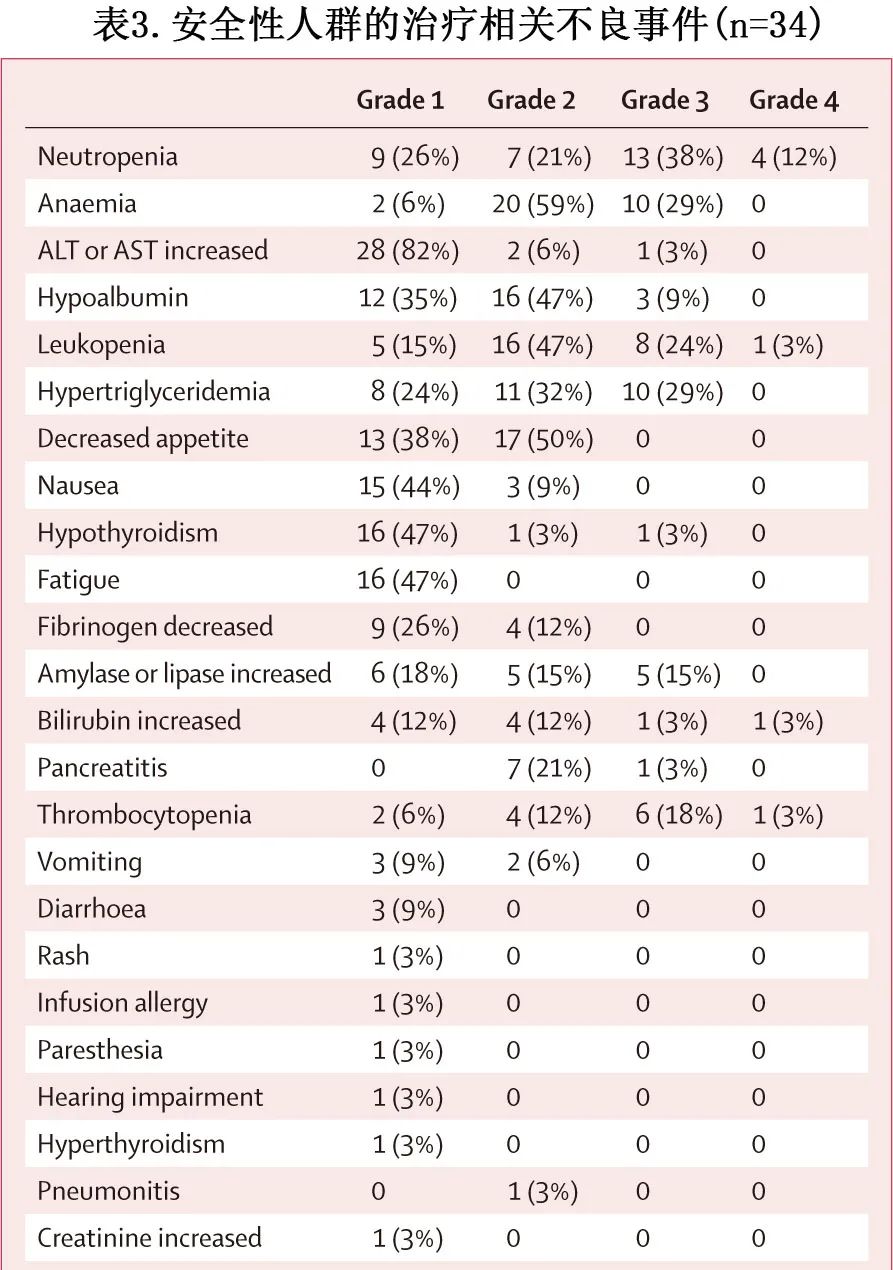
最常见的治疗相关不良事件包括中性粒细胞减少症(33/34,[97%])、贫血(32[94%])、转氨酶升高(32[94%])、天冬氨酸转氨酶升高或丙氨酸转氨酶升高(31[91%])和白蛋白降低(31[91%])。大多数(32[94%])治疗相关不良事件发生于诱导治疗的前4个周期。在34例患者中,29例(85%)发生≥3级治疗相关不良事件,最常见的≥3级的治疗相关不良事件包括中性粒细胞减少症(17[50%])、贫血(10[29%])和高甘油三酯血症(10[29%])。甲状腺功能减退是最常见的免疫相关不良事件(18例[53%]),包括1例(3%)患者发生3级甲状腺功能减退。34例患者中有4例(12%)因血液学毒性降低剂量;1例(3%)患者因3级甲状腺功能减退停止治疗,甲状腺功能减退经治疗后缓解,但在停止免疫化疗5个月后突然不明原因死亡,与研究治疗无关。另有2例死亡:1例死于噬血细胞综合征,1例死于疾病进展。所有治疗相关不良事件均可控,无死亡评估为与治疗相关。
作者评估34例患者的基线血浆EB病毒DNA。基线时,中位EB病毒DNA拷贝数为1230拷贝/mL。基线EB病毒DNA拷贝数<1230拷贝/mL的患者(16/17[94%])与≥1230拷贝/mL的患者(13/17 [77%])的CR率无差异(p=0.34)。对34例患者血浆EB病毒DNA拷贝数进行动态监测,大多数患者在第2周期仅达到PR,而大多数患者在第4周期达到CR(图2),因此选择第4周期作为评估EB病毒DNA拷贝数和CR率关联的最佳时间窗。第4周期后,中位EB病毒DNA拷贝数为0拷贝/mL。在第4周期未检出EB病毒DNA的患者的CR率高于检出EB病毒DNA的患者(96%[22/23] vs 64%[7/11];p=0.029)。此外,第4周期血浆EB病毒DNA清除也显著有利于PFS(清除:24个月PFS率81% vs未清除:12个月PFS率50%,HR=0.122,p=0.0033),提示在预测接受信迪利单抗联合P-GEMOX治疗的患者结局方面,第4周期的血浆EB病毒DNA清除比基线EB病毒DNA拷贝数更具有临床意义。此外,EB病毒DNA拷贝数随着疾病进展而增加,并且在疾病进展时没有患者出现血浆EB病毒DNA清除。此外,未观察到EB病毒DNA拷贝数与DFS和OS之间存在关联。
总结
该研究是首个评估信迪利单抗联合P-GEMOX治疗一线晚期ENKTL的II期研究,纳入34例患者,中位年龄39岁,25例(74%)为男性;9例(26%)为女性;均为亚裔。中位随访时间为21个月。完全缓解率为85%(29/34),达到主要终点,部分缓解率为5例(15%),ORR为100%(34/34)。24个月PFS为64%,24个月DFS为72%,36个月OS为76%。最常见的3-4级治疗相关不良事件包括中性粒细胞减少症(17/34[50%])、贫血(10[29%])和高甘油三酯血症(10[29%])。甲状腺功能减退是最常见的免疫相关不良事件(18[53%]),包括1例(3%)患者发生3级甲状腺功能减退导致治疗终止。无严重不良事件发生。有3例死亡:1例死于噬血细胞综合征,1例死于疾病进展,1例死于原因不明,均与治疗无关。
总的来说,虽然该研究存在一些局限性,例如单臂设计、样本量小、随访时间不足等,以及缓解率的提高能否转换为长期生存获益和生存平台期还需继续随访,但仍可证明信迪利单抗联合P-GEMOX一线治疗晚期ENKTL安全有效。该研究为晚期ENKTL患者提供了有前景的系统治疗选择,期待SPIRIT研究的成熟结果,而更多、更大样本量的研究将优化联合治疗方案,更重要的是应关注分子生物学,为个体化精准免疫化疗提供指导。
参考文献
1.Tian X,et al.First-line sintilimab with pegaspargase, gemcitabine, and oxaliplatin in advanced extranodal natural killer/T cell lymphoma (SPIRIT): a multicentre, single-arm, phase 2 trial.Lancet Haematol . 2024 Mar 27:S2352-3026(24)00066-8. doi: 10.1016/S2352-3026(24)00066-8.
2.Qi S,Li Y.First-line immunochemotherapy for extranodal natural killer/T cell lymphoma.Lancet Haematol . 2024 Mar 27:S2352-3026(24)00071-1. doi: 10.1016/S2352-3026(24)00071-1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#P-Gemox# #结外NK/T细胞淋巴瘤# #信迪利单抗#
19