Cancer Cell:提高 CAR-T 疗效的新思路:调节肌酐代谢通路
2024-02-22 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
该研究发现通过直接补充或过表达腺苷脱氨酶,可增加肌苷(INO)水平,从而增强CAR-T细胞的功能和干性。
CAR-T细胞疗法是一种将嵌合抗原受体(CAR)导入T细胞,使T细胞获得特异性识别和杀伤肿瘤细胞的能力的技术。腺苷(Ado)是一种免疫抑制性核苷,在肿瘤微环境中起着重要作用。CD39和CD73是Ado生成的关键酶。过去的研究表明功能衰竭的CAR-T细胞表面表达CD39和CD73,可以通过生成Ado来介导免疫抑制。但是如何防止Ado介导的免疫抑制,从而提高CAR-T细胞的功效,仍有待探寻。
近日,由斯坦福大学医学院 Crystal L. Mackall 团队发表于 Cancer Cell 的题为Inosine induces stemness features in CAR-T cells and enhances potency 的文章,发现通过直接补充或过表达腺苷脱氨酶,可增加肌苷(INO)水平,从而增强CAR-T细胞的功能和干性。

首先,CD39是CAR-T细胞功能减弱的标志。大量耗竭的CD39+ CAR-T细胞共表达CD73,产生腺苷(Ado)并通过A2aR介导免疫抑制。而腺苷脱氨酶(ADA)可将腺苷(Ado)分解为肌苷(INO),从而减少Ado介导的免疫抑制。为此,研究设置了ADA过表达的实验组(ADA-OE)。针对转录组学和表型特征的研究发现,腺苷脱氨酶的过表达(ADA-OE)增加了CAR-T细胞的干性特征,降低了终末分化。

与对照组相比,ADA-OE诱导与干性相关的基因上调,与效应功能相关的基因和耗竭相关的基因下调。
接着,在体外实验中,为了测试肌苷(INO)是否可以调节慢性活化CAR-T细胞的干性,研究团队在无葡萄糖条件下,使用含有11mM肌苷(INO)的培养基培养CAR-T细胞。结果发现,与对照组相比,INO可上调与干性相关的转录本, INO增加了CAR-T细胞的干性特征,增强了CAR-T细胞的功能,并消除了慢性活化CAR-T细胞的免疫抑制,且不依赖于葡萄糖的存在。

肌苷(INO)在体外诱导干细胞并增强CAR - T细胞的功能
然后,研究团队进行了体内实验。在Nalm6-GD2白血病模型中, HA-INO-与HA-CAR-T细胞相比,肿瘤生长延迟,总生存率提高。在针对CD19白血病的应激测试中,INO处理的CD19-CAR-T细胞在体内也表现出更高的抗肿瘤活性。另外,在Her2-CAR骨肉瘤模型中,亦能观察到在接受Her2-INO-CAR治疗17天后,小鼠血液中的循环T细胞比对照Her2-CAR-T细胞多10倍。这些结果表明INO在血液系统和实体瘤中均可增强CAR-T细胞的抗肿瘤能力和持久性。
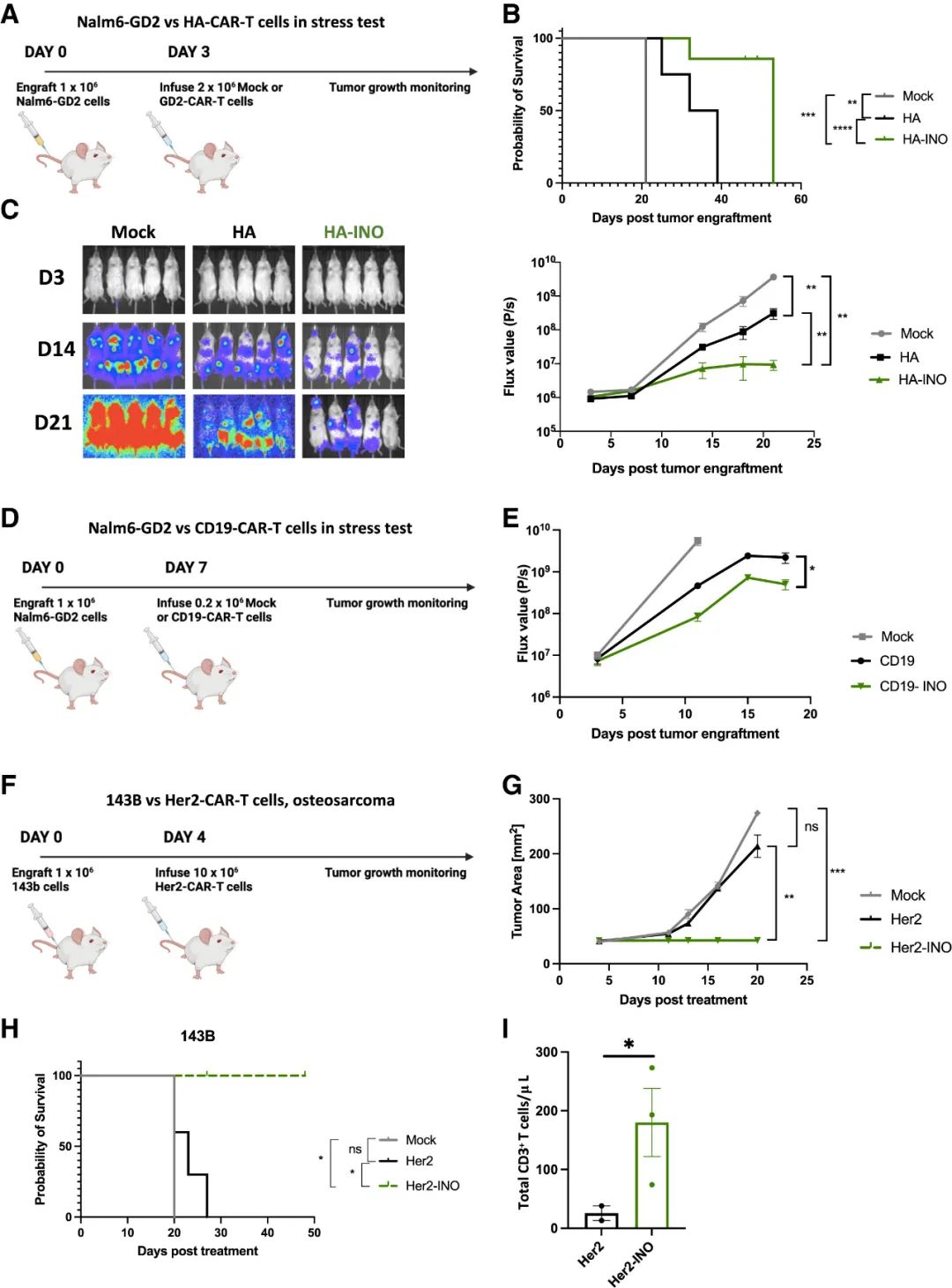
肌苷(INO)在体内增强CAR-T细胞抗肿瘤功能
接下来,研究团队探索了INO对CAR-T细胞代谢的影响。通过单细胞蛋白组学分析发现,INO可减少CAR-T细胞糖酵解途径相关酶的表达,增加谷氨酰胺酶和多胺代谢酶的表达,提示INO可重新编程CAR-T细胞的代谢。
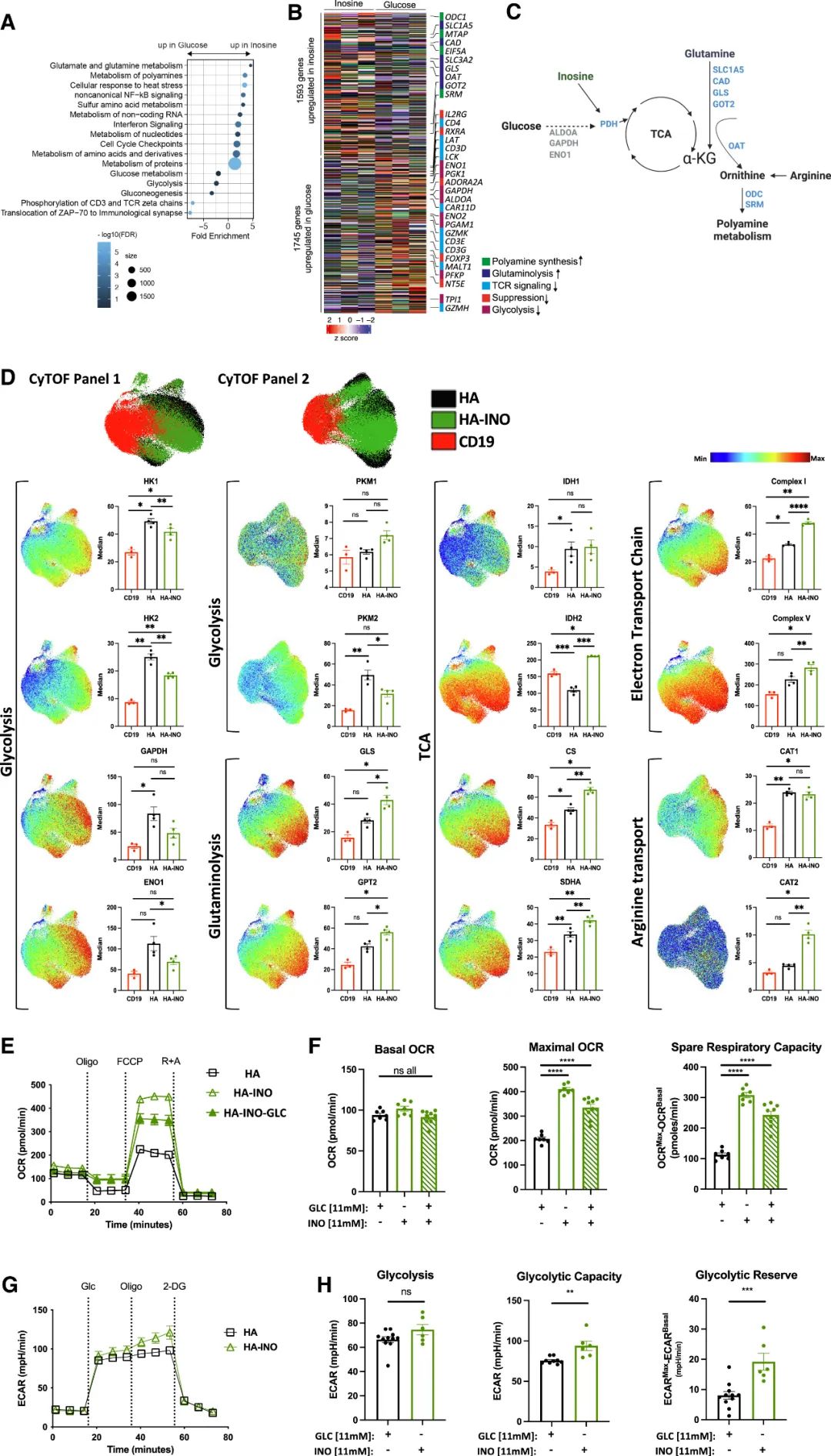
肌苷(INO)可重新编程精疲力竭的CAR-T细胞的代谢
另外,在表观遗传学方面,INO通过增加多胺代谢诱导表观遗传重编程HA-CAR-T细胞,ATAC-seq结果显示INO诱导广泛的染色质可及性变化,也证明了INO提升了CAR-T细胞的干性。

INO通过增加多胺代谢诱导表观遗传重编程HA-CAR-T细胞
此外,在大规模临床级生产方面,与使用标准葡萄糖基培养基制造的细胞相比,使用INO培养基大大提升了CAR产品的质量,符合临床标准。

临床规模生产GD2-CAR-T细胞使用含有INO的培养基提高了CAR产品的质量
总之,本研究探究了腺苷(Ado)在CAR-T细胞衰竭中的作用,以及通过细胞内途径增强CAR-T细胞疗效的可能性。结果发现,过表达腺苷脱氨酶(ADA)或使用肌苷(INO)可显著改变CAR-T细胞的转录组、表型和功能,增加CAR-T细胞的多胺代谢,改变细胞的代谢重编程和表观遗传状况,显著增强CAR-T细胞的功能和干性。
此外,作者证明了在GMP级制备过程中使用肌苷(INO)培养基扩增CAR-T细胞的可行性。这些CAR-T细胞表现出增强的体内和体外抗肿瘤活性。总体而言,本研究确定了在GMP细胞制造过程中引入INO是一种可行的策略,可以生成更强效的CAR-T细胞。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#CAR-T# #肌苷#
29