Science:表观遗传学和数学结合,预测癌细胞行为
2023-02-20 nagashi “生物世界”公众号 发表于上海
在癌症的发展过程中,表观遗传变化促进了表型的可塑性,使得癌细胞的行为持续变化并有助于增强肿瘤的转移和免疫逃逸能力。如果我们能建立一个表观遗传相关的数学模型,或许就能精准预测肿瘤的发展。
随着遗传学的发展,科学家们发现,个体性状的改变并非完全来源于基因序列的变化。在某些情况下,即使两个个体的基因序列完全相同,在不同的环境下也能表现出截然不同的表型,而这就是表观遗传(Epigenetic)。
值得注意的是,在癌症的发展过程中,表观遗传变化促进了表型的可塑性,使得癌细胞的行为持续变化并有助于增强肿瘤的转移和免疫逃逸能力。如果我们能建立一个表观遗传相关的数学模型,或许就能精准预测肿瘤的发展,从而为癌症患者定制治疗计划。
近日,约翰·霍普金斯大学的 Andrew P. Feinberg 和耶鲁大学的 Andre Levchenko 在国际顶尖学术期刊 Science 上发表了题为:Epigenetics as a mediator of plasticity in cancer 的论文。

这篇综述论文指出,通过数学建模可以将癌症的表型可塑性与驱动癌症的表观遗传变化联系起来。这种新的表观遗传定量方法可以更好地定义和测量基因功能中的表观遗传学缺陷及其与癌症遗传景观的相互作用,从而更好、更早地诊断癌症并预测其行为。
沃丁顿表观遗传景观
早在1957年,英国发育生物学家康拉德·沃丁顿(Conrad Waddington)就尝试理解环境信号对于细胞基因组的影响。他在胚胎发育过程中注意到,成千上万不同类型的细胞(神经元、肌细胞、血细胞以及精细胞等等)均源自同一个受精卵。
沃丁顿做了一个非常形象的比喻:胚胎分化的过程就像无数颗弹珠从沟壑纵横的斜坡上滚落。他认为每个发育中的细胞在“沃丁顿表观遗传景观”中都有自身独特的路径,但是由于它们在途中被困在某些特殊的沟坎或缝隙中,因此限制了细胞分化的类型。

沃丁顿表观遗传景观
如今,表观遗传变化已被简要地视为一种发育景观,可以引导特定的分化事件,并定义和限制不同的表型和基因表达状态,而癌症的发生和发展被视为这一景观的逆转或变形。值得一提的是,在物理学科中,势能景观及其与物理或化学状态的概率分布的关系已经发展和完善了几十年。最近,这种数学模型也被应用于更定量地描述沃丁顿表观遗传景观。

癌症的表观遗传景观和表型可塑性
从某些特点来看,势能景观与沃丁顿景观十分相像,细胞的分化程度可以类比势能的高低,表观遗传变化可以类比系统变量。因此,这种方法在描述癌症表观遗传景观时特别有吸引力,因为在这种景观上实现的细胞状态的可塑性是疾病的功能核心。
癌症表观遗传景观的数学建模
近些年来,生物定量技术在更微观的层面有了长足的发展,包括mRNA和蛋白质表达的单细胞分辨率分析,以及DNA和组蛋白表观遗传修饰的分子分析。这些新的实验技术丰富了科学家们对基因组信息和表观遗传控制所定义的表型状态多样性的理解。
在这篇综述论文中,Andrew Feinberg 和 Andre Levchenko 扩展了一个新兴的观点:即使是在正常稳态组织或细胞培养中定义明确的细胞系,其生物分子的表达也有相当大的可变性。这一发现表明,生物过程可能本质上是随机的,细胞水平上的生物可变性可以指示甚至驱动生物功能的重要方面。
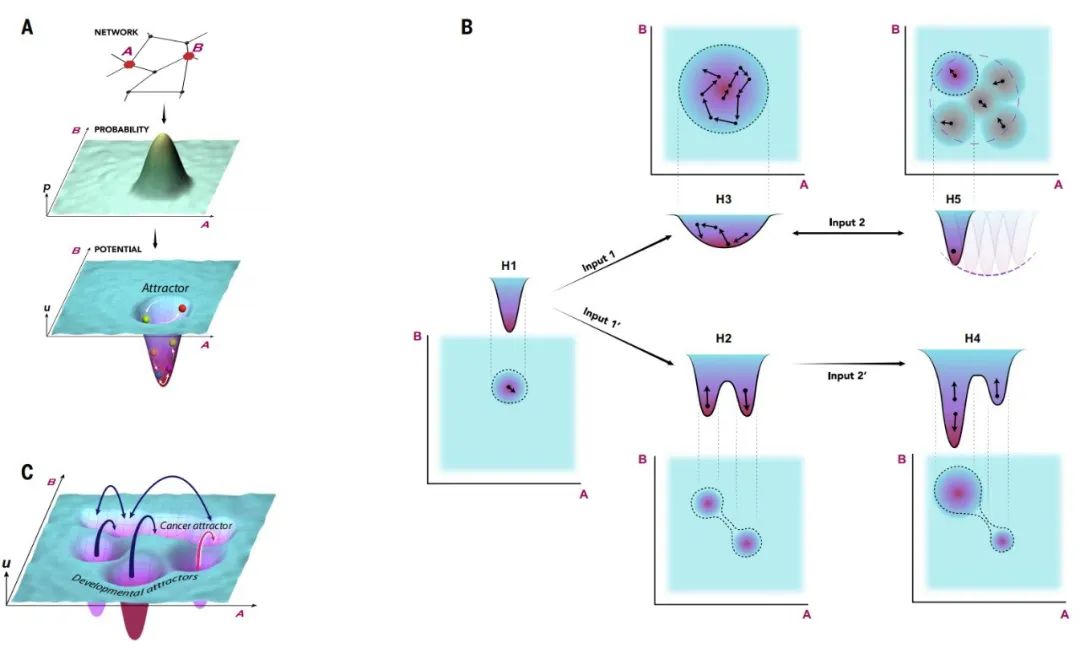
基因表达和表观遗传景观控制着正常细胞和癌细胞的功能
这种分析还能够评估不同细胞状态的概率分布,或准势能,并利用这些来确定相关的熵——一种信息不确定性的度量。Andrew Feinberg 和 Andre Levchenko 详细定义的这些措施,能够精确和定量地定义潜在的表观遗传景观,协调地反映基因表达景观。通过将癌症生物学和数学相结合,可以将癌症细胞与正常细胞区分开来,并量化和测量细胞状态的表观遗传调控及其如何影响细胞行为。
具体而言,癌症相关的遗传和表观遗传改变可以增加景观的整体熵,并导致更高的可变性和其他神秘吸引子的占用。熵的增加和反应的异质性正在成为癌症发病机制中景观变形的一个关键且经常被忽视的特征,熵的变化也可以伴随细胞分化和衰老,从而进一步解析癌症的病因。此外,熵的变化还允许区分表型可塑性和表型异质性。
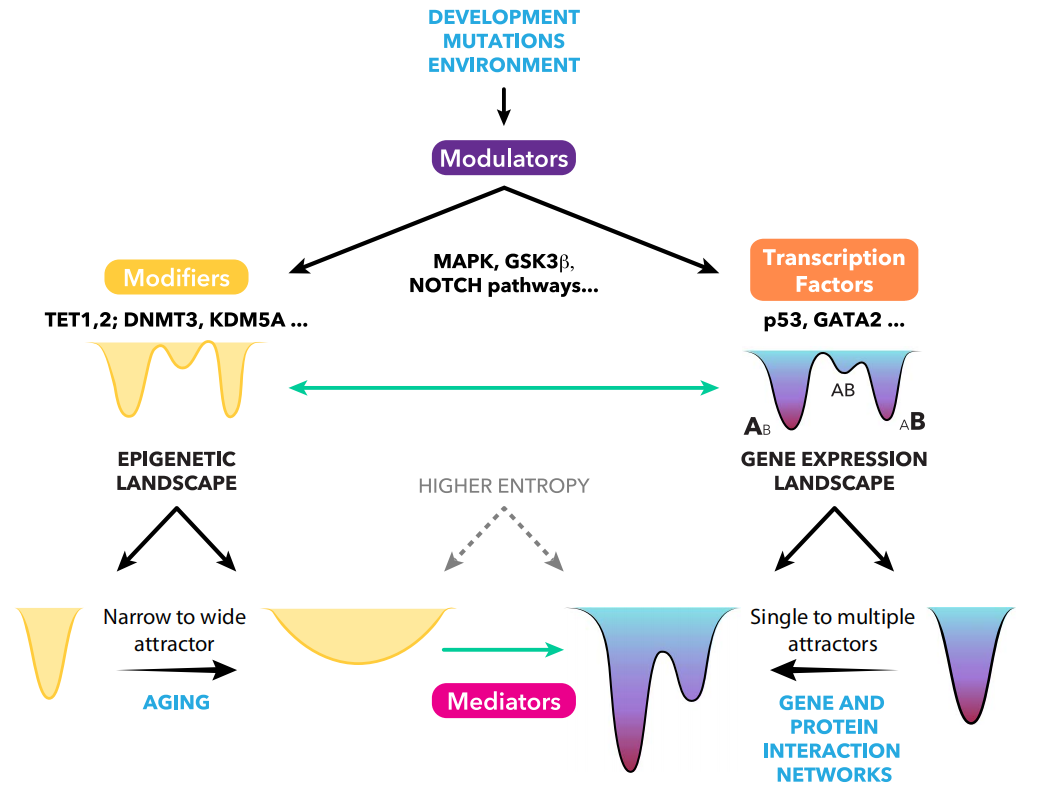
表观遗传学和基因表达景观之间的相互作用
通过景观概念化,这篇综述论文概述了在癌前和癌进展过程中可能发生的几种情况。不仅如此,他们还讨论了使这些场景成为可能的分子机制,将它们与特定的景观转变联系起来,并建议如何定量评估表观遗传景观改变和相应的表型变化之间的关系,用于进一步了解信号通路中的信息传递和开发新的治疗干预措施。
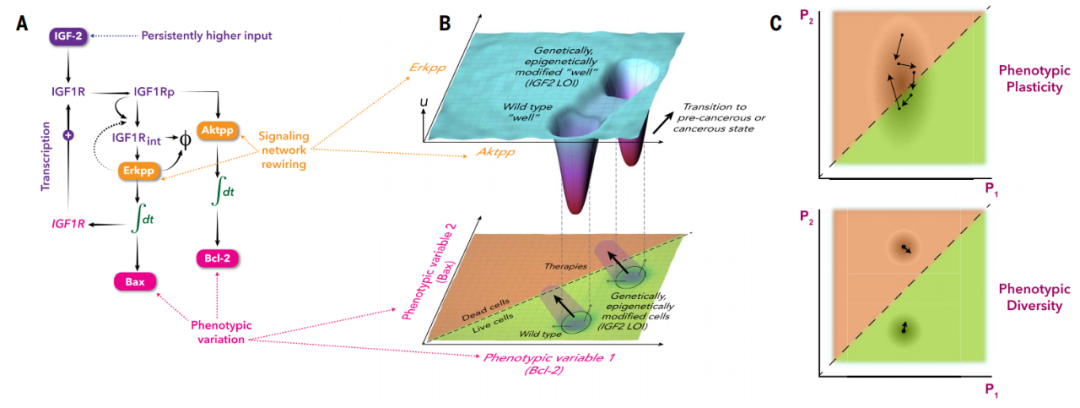
表观遗传景观和可变表型结果之间的联系
Andrew Feinberg 表示,数学提供了强大的工具,实现癌症表观遗传景观的定量分析,并将癌症的表型可塑性与驱动癌症的表观遗传变化联系起来,为认知癌症表观遗传学调节网络打开了新的大门。
细胞分化的表观势能景观
事实上,通过数学建模模拟细胞分化过程成为了近年来发育生物学的热门研究领域之一。2022年6月17日,中国科学院分子细胞科学卓越创新中心陈洛南研究员、北京大学数学院李铁军教授、日本东京大学合原一幸教授合作在 National Science Review 期刊发表题为:Energy landscape decomposition for cell differentiation with proliferation effect 的研究论文。

该研究建立了一个具有增殖效应的细胞分化景观理论,并将细胞的发育过程建模为一个具有生灭项的随机动力系统。该理论表明,在考虑生灭项的情况下,系统可以分解为两个势能项和一个非梯度项。其中,细胞类型势能景观U使用不同的亚稳态代表了不同的细胞类型;多潜能性势能景观V的数值大小则体现了相应状态细胞的干性,并由负梯度方向揭示了细胞分化的总体方向。
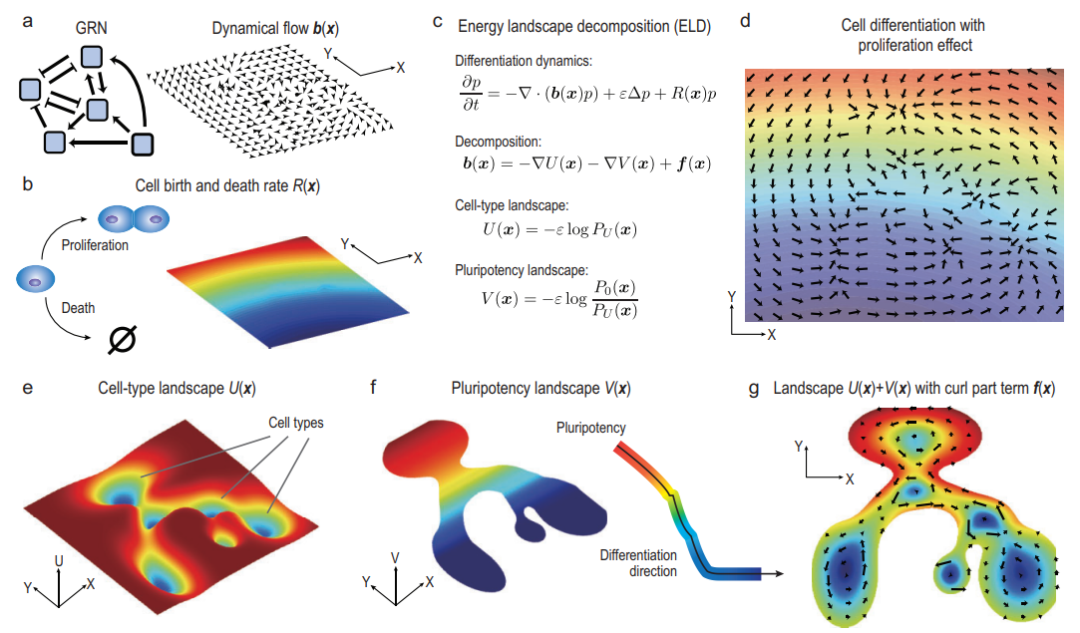
根据基因调控网络(GRN)和细胞生灭率R进行势能景观分解
此外,针对低维模型和高维模型的不同特点,研究团队提出了对应的势能景观分解算法。低维模型使用流线扩散法(stream-line diffusion method),而高维模型需要对加权轨道进行平均场近似(mean-field approximation)。该理论和相应算法在对流扩散过程、两基因调控网络、T细胞分化过程等系统中进行实例验证和应用。
这套理论将为细胞分化过程及各种复杂生物过程的建模、势能景观理论的发展及同类型的动力学系统分析,提供有效的数学工具和计算方法,具有广泛的拓展和应用前景。
结语
总而言之,这篇发表在 Science 的综述论文表明,在癌症表观遗传景观定量分析中,新的综合理论和实验方法为理解癌症的表观遗传变化和环境驱动因素之间的联系以及调节景观的表观遗传调节网络之间的关系提供了前所未有的工具。
随着单细胞测量技术的持续进展,包括DNA甲基化评估、基因组测序和染色质分析,将允许进一步了解日益复杂的景观动态,并解释肿瘤进化、侵袭性和转移性扩散的进展。此外,对生物随机性(数学上定义为表观遗传和基因表达熵)的更深入理解,可以揭示癌症的免疫逃逸机制以及后续的病情进展,为患者量身定制最合适的治疗方案。
Andrew Feinberg 表示,如果我们了解这些过程,也许能够识别发生在癌细胞中的表观遗传变化,从而更好、更早地诊断癌症并预测其行为,这样我们就可以用更有针对性的疗法进行干预。这些定量方法必将成为治疗的一部分,没有它们,我们就无法了解癌症。
原始出处:
ANDREW P. FEINBERG, et al. Epigenetics as a mediator of plasticity in cancer. SCIENCE, 10 Feb 2023, Vol 379, Issue 6632.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言