皮肤是覆盖于人体表面的最大器官,承担着抵御外界有害环境、保护机体健康的重要使命,还发挥着感知外界环境变化并传递信号使机体做出适应性变化的职能。因此,皮肤结构的完整和功能正常对人体健康的维持极其关键。
近年来,生命科学领域的快速发展,尤其是表型组学研究的不断深入,带动皮肤屏障的研究也涌现了诸多有价值的成果,微观分子水平的研究成果尤其显著。从表型组学研究的视角归纳皮肤屏障多维度前沿研究成果,能够为屏障修护策略提供更系统全面的解决方案。
皮肤屏障影响因素
狭义的皮肤屏障主要就指表皮屏障,特别是角质层的物理屏障和机械作用,表皮屏障依据其主要功能又分为渗透屏障、抗微生物屏障、抗氧化屏障、免疫应答屏障和光防护屏障,当这些功能屏障发生异常时,就会影响皮肤的正常生理功能,若不能及时修护则会导致问题皮肤或皮肤疾病。
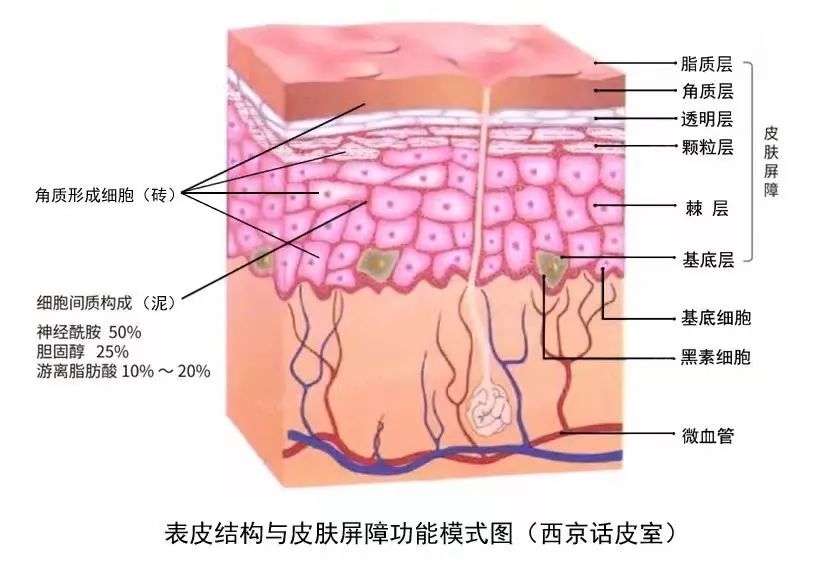
表皮蛋白质终末分化的有序进行是维持皮肤屏障结构和功能正常的关键因素。表皮基底层的角质形成细胞不断向外增殖分化形成棘细胞层、颗粒层和角质层,这种分层所形成的结构和功能差别正是皮肤表皮屏障的生理基础。在表皮细胞分化过程中角蛋白(keratin,KRT)和KRT中间丝相关蛋白(keratin intermediate filaments associated protein,KIFAP)的时空特异性表达既是表皮不同分层结构的生物标记,也是不同分层结构实现其生理功能的物质基础。
既往研究证明,人群遗传结构和生活环境均能影响皮肤屏障系统的功能,且大都与表皮蛋白质终末分化的调控相关。外界环境因素对皮肤屏障的影响巨大,其中光因素是损伤皮肤屏障的最主要外因之一。紫外线、可见光和红外线均能导致皮肤屏障损伤、光老化,甚至发生癌变。光辐照引发的皮肤屏障破坏疾病有日光性荨麻疹(solar urticaria)、光接触性皮炎(photocontact dermatitis)及皮肤卟啉病(cutaneous porphyria)等。
湿度和温度的变化也会促进促炎性细胞因子和皮质醇释放,使皮肤易发生过敏反应。不当护肤亦会影响皮肤屏障结构和功能,使皮肤对外界刺激的抵御作用减弱,皮肤大量失水导致干燥、粗糙、刺痛和瘙痒,造成敏感性皮肤状态。空气颗粒物的污染能够诱发氧化应激、炎症和细胞凋亡等病理变化,破坏皮肤屏障结构的稳定性。各类环境因素所造成屏障损伤的机制虽各有不同,但基本都会影响KRT和KIFAP等表皮细胞分化相关蛋白的基因表达、翻译和翻译后修饰,甚至代谢。
皮肤屏障调控的分子机制
影响影响皮肤表皮屏障的遗传因素:
皮肤屏障功能疾病例如特应性皮炎(atopic dermatitis,AD)是高度可遗传疾病。全基因组关联分析研究表明,皮肤屏障相关的中间丝聚蛋白(filaggrin,FLG)和白介素(interleukin,IL)-4/13等基因上约31个单核苷酸多态位点与AD相关,说明遗传因素在皮肤屏障正常结构和功能维持中发挥着重要作用。
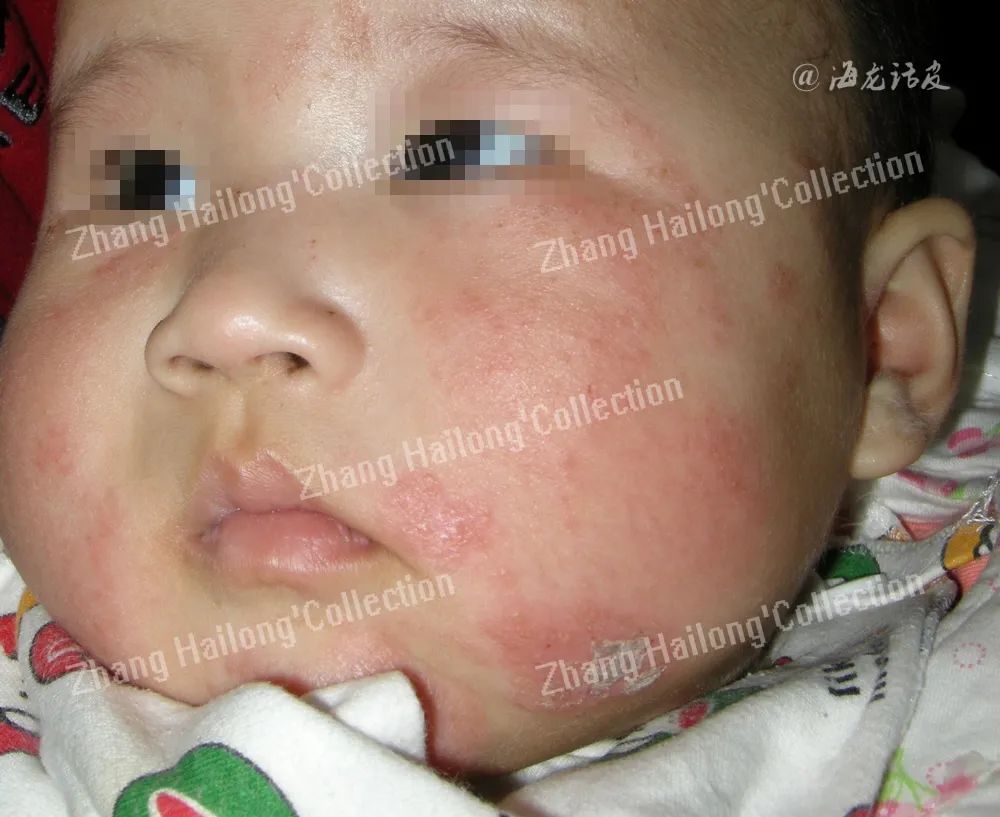
KRT负责维持表皮组织机械完整性和坚韧皮肤屏障。KRT突变形成脆弱角质,导致多种疾病,包括单纯性大疱性表皮松解症(KRT5、KRT14)、角质化鱼鳞病(KRT1、KRT2、KRT10)和掌跖角化病(KRT9)等。FLG编码的丝聚蛋白能分解为NMF,调节皮肤水合作用。高达50%的中度至重度特应性皮炎患者广泛存在FLG基因突变。
而一项有关婴儿特应性湿疹(atopic eczema)的研究结果显示,FLG突变与经皮水分流失(transepidermal water loss,TEWL)增加具有相关性,表明婴儿特应性湿疹的发生与FLG突变有关。丝氨酸肽酶抑制剂Kazal型5(serine protease inhibitor Kazal-type 5,SPINK5)基因及闭合蛋白claudin基因突变也与皮肤屏障损伤有关。这些结果提示,表皮蛋白在皮肤屏障正常结构和功能的维持中发挥着关键作用。
皮肤屏障功能在正常人群中也存在差异,国内科研人员对皮肤屏障特征参数TEWL进行了全基因组关联分析,结果发现,染色体9q34.3区域的一系列单核苷酸多态位点与TEWL显著相关,其中最显著的位点为位于基因间区的rs11103631。尽管该位点参与屏障功能调控的机制尚未可知,但该研究首次从基因组水平开始对个体皮肤屏障功能差异进行探索。
影响皮肤屏障的表观遗传学修饰:
表观遗传机制在皮肤屏障中具有重要作用,在皮肤屏障损伤相关疾病,如银屑病(psoriasis)和特应性皮炎(atopic dermatitis)中均发现了表观遗传学修饰的异常改变。银屑病皮损部位细胞中DNA呈高甲基化,并与银屑病面积严重程度指数评分增高相关。
特应性皮炎中的甲基化模式在血细胞中没有差异,而皮损部位表皮与正常皮肤间甲基化差异显著,功能聚类显示,这些异常甲基化的基因主要与表皮分化和先天免疫反应相关。这些研究结果表明,表观遗传学修饰参与皮肤屏障结构和功能的调控。
皮肤屏障的转录组学特征:
国内研究人员通过对早期皮肤屏障损伤细胞进行RNA-seq分析,发现IL-17信号通路、肿瘤坏死因子信号通路上调,同时角质形成细胞分化和皮肤发育相关基因差异显著,KRT基因与晚期角化包膜基因高度交互。说明皮肤屏障受损刺激炎症反应,同时启动角质形成细胞重塑表皮结构。Nattkemper等使用RNA测序技术分析AD、银屑病与健康皮肤细胞中基因转录水平的差异,发现IL-17等炎性细胞因子在瘙痒性皮损中呈高表达。
Tham等使用全转录组测序发现,AD患者的异位嗅觉受体表达水平高于健康人群,异位嗅觉受体可以影响皮肤屏障稳态以及角质形成细胞的增殖、迁移及分化。对皮肤单细胞转录组进行分析,发现AD皮损部位存在一类COL6A5和COL18A1基因表达阳性的成纤维细胞新亚型,该类细胞表达趋化因子(CC基序)配体(CC chemokine ligand,CCL)2和19可能参与免疫细胞的活化和炎症反应的调控,该过程可能也参与了皮肤屏障基因的调控。
皮肤屏障的蛋白质组学特征:
蛋白质组学分析研究显示,AD患者的皮肤中NMF、表皮蛋白、蛋白酶-蛋白酶体复合物和脂质代谢特征均发生异常下调,且伴有抗氧化和炎症过程失衡。与无食物过敏的AD患者相比,AD合并食物过敏者有45种蛋白与皮肤经表皮水分流失及过敏程度高度相关。
皮肤的化学屏障包括大量的抗菌肽,其表达受维生素D途径影响。同时,通过调节菌群的组成影响皮肤功能。Lai等证实皮肤共生菌表皮葡萄球菌能增加皮肤角质形成细胞抗菌肽的表达。Ommori等发现,皮肤存在的不同葡萄球菌属能诱导角质形成细胞产生不同的抗菌肽,致病性和非致病性金黄色葡萄球菌诱导血红蛋白亚基δ的不同亚型产生。上述研究说明,抗菌肽在皮肤微生态屏障的稳态维持中发挥着重要的调节作用。
皮肤屏障的脂质组学特征:
皮肤脂质组学研究显示,皮肤表面的脂类物质主要有神经酰胺、三酰甘油、二酰甘油、磷脂酰胆碱、游离脂肪酸和角鲨烯等,其中神经酰胺是细胞间脂质的关键成分,对其结构研究表明,酰基甘油是形成长链结构和脂质的正交侧向堆积所必需的,亦是维持皮肤脂质结构所必需的。因此,神经酰胺类的稳定表达对于皮肤角质层脂质的稳定、致密组织以及表皮屏障的良好功能是必需的。同时,神经酰胺也被证明通过发挥抗增殖、促凋亡和免疫调节作用来调节角质形成细胞增殖和分化平衡。
皮肤屏障的代谢组特征:
水脂膜的水合作用是支持皮肤屏障功能的重要机制,主要依靠NMF中大量高吸湿性化合物来维持,例如尿酸、吡咯烷酮-5-羧酸、精氨酸、鸟氨酸和尿素等,这些化合物很多是FLG的分解产物。表皮脂蛋白加工成丝聚合蛋白单体转化为NMF的小化合物过程中,干扰酶活性则会对角质层的屏障功能产生不利影响。甘油、乳酸盐以及钾离子对于维持足够的水合作用水平也至关重要。在水通道蛋白-3敲除小鼠中,甘油/水转运到表皮和角质层最上部的过程受损会导致皮肤干燥、缺乏弹性以及屏障恢复延迟。
皮肤屏障修护的新靶点和策略
RNA干扰对KRT突变的治疗策略:
KRT在皮肤屏障结构形成、维持以及屏障正常功能中均具有关键作用,KRT的表达和结构异常均会诱发皮肤屏障损伤,甚至皮肤疾病,因此,针对KRT的调控是皮肤屏障修护中的核心内容之一。
近年来,RNA干扰,特别是以短干扰RNA(small interfering RNA,siRNA)的形式已成为诱导等位基因特异性基因沉默的可能方法。目前已针对先天 性甲肥厚(pachyonychia congenita,PC)中KRT6a基因的关键突变等位基因开发了特异性siRNA,并在PC患者脚部的匹配角化过度病灶中注射siRNA,几周后病变和疼痛消退,该研究为等位基因特异性siRNA治疗提供了有力证明。该领域现在面临的挑战是找到一种有效且非侵入性的方法,将siRNA递送到皮肤或其他组织中。目前正在探索的途径是siRNA的化学修饰、局部配方和微针阵列等物理方法。
调节FLG表达进行皮肤屏障修护:
基于对FLG在皮肤屏障损伤疾病中的重要作用,屏障损伤性皮肤疾病中FLG往往呈现低表达模式,通过上调FLG表达可能是皮肤屏障受损的潜在修护方法。
Stout等在皮肤外植体和小鼠模型中局部应用与细胞穿透肽相连的FLG单体,该组合物能够穿透表皮组织,进入到细胞中发挥作用,并能修复屏障功能,未来需要进一步确定其临床安全性和有效性。此外,体外研究显示,L-组氨酸可显著增加FLG的产生,并改善人体皮肤外植体的皮肤屏障功能;口服L-组氨酸可显著改善AD患者的体征和症状。因此,补充可诱导表达FLG的代谢物或也能发挥皮肤屏障修护功效。
微生物群和皮肤分泌物对皮肤屏障功能的维持:
微生物发酵产物是经微生物工程培养、灭活及分解得到的代谢产物、细胞质片段、细胞壁组分及多糖复合体,可满足皮肤微生态系统的多种营养需求。研究表明,微生物发酵滤液能通过提高角化包膜相关标志蛋白表达、降低神经元反应性和神经元可及性来降低皮肤敏感性。这些研究表明,微生态靶点在皮肤屏障修护中拥有巨大潜能。

透明质酸(hyaluronic acid,HA)作为人体皮肤表皮的主要基质成分之一,具有很强的水合能力。外用HA能调节角质形成细胞分化,抑制炎症水平,并增强内源性HA的生成发挥保湿作用,进而修护皮肤屏障。研究表明,面部光老化患者外用HA后,皮肤含水量即刻增加134%;继续维持治疗6周,皮肤含水量仍可增加55%;湿疹、激素依赖性皮炎等患者在抗炎的基础上联合外用HA可显著提高疗效、降低复发率 ;激光美容术后外用HA能够有效改善红肿、灼热等症状,促进皮肤结痂脱落。
植物提取物在皮肤屏障修护中的作用:
植物提取长期以来一直被用于皮肤美容和医疗,诸多研究表明植物油具有积极生理作用。例如,植物油可以通过闭塞效应充当皮肤的保护屏障,使皮肤保持水分,降低TEWL值;先前对植物油的研究表明,杏仁油、荷荷巴油、大豆油和鳄梨油局部应用时大多保留在皮肤表面,不会深入渗透。酚类化合物和生育酚等其他组分具有抗氧化作用,并可调节皮肤屏障稳态、炎症和伤口愈合等生理过程。
结语
皮肤屏障的正常功能依靠表面微生物、多种皮肤细胞、代谢物、蛋白质、基因调控和遗传结构共同维持,人体内部环境失衡和外界环境多变均易破坏皮肤屏障稳态导致问题皮肤或皮肤疾病发生。
近年来,皮肤屏障调控的分子机制研究更加深入,组学新技术的涌现,指导了一系列皮肤屏障修护的新靶点开发,不仅包括传统局部施用药物或代谢物的治疗手段,还出现了利用皮肤菌群和小RNA治疗皮肤屏障受损的新理论,为进一步探索皮肤屏障功能和改善皮肤屏障状态提供了理论基础。
参考文献:
[1]谈益妹,赵毅,刘玮等.皮肤屏障调控机制和修护策略的研究进展[J].世界临床药物,2023,44(1):77-82.
[2]张书婷,杨春俊,杨森.皮肤屏障影响因素的研究进展[J].中国美容医学,2016,25(12):110-112.
[3]戴茹,李利,陈伟.可见光的皮肤损伤及防护[J].实用皮肤病学杂志,2018,11(2):90-93.
[4]王高峰,刘芳,孔庆涛,等.皮肤屏障相关免疫细胞的研究进展[J].医学研究生学报,2012,25(2):195-199.
[5]Eyerich S,Eyerich K,Traidl-Hoffmann C, et al. Cutaneous barriers and skin immunity: differentiating a connected network[J]. Trends Immunol,2018,39(4):315-327.
[6]其他参考文献略。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







