TCT:CAR-T治疗B细胞淋巴瘤,符合SCHOLAR-1标准患者预后较差
2023-10-15 聊聊血液 聊聊血液 发表于上海
西班牙一项多中心、回顾性、观察性研究,在三百多例接受CAR-T治疗的侵袭性B细胞淋巴瘤中,分析了符合或不符合 SCHOLAR-1 标准的 ABCL 患者在缓解率和生存期方面的差异。
SCHOLAR-1标准
CAR-T细胞疗法越来越成为侵袭性B细胞淋巴瘤(aggressive B cell lymphoma,ABCL)的标准治疗,其中axicabtagene ciloleucel (axi‐cel)和lisocabtagene maraleucel (liso-cel)甚至在二线治疗中优于自体移植,如果在12个月内复发或一线治疗难治。
在CAR-T前时代,SCHOLAR-1研究确定了一组预后极差的难治性患者,具体标准包括:任何线治疗的最佳缓解为疾病进展、一线治疗≥4个周期或后线治疗≥2个周期的最佳缓解为疾病稳定,或自体SCT后<12个月复发。既往研究也在CAR-T时代确定了SCHOLAR-1标准的作用。
《Transplantation and Cellular Therapy》近日发表西班牙一项多中心、回顾性、观察性研究,在三百多例接受CAR-T治疗的侵袭性B细胞淋巴瘤中,分析了符合或不符合 SCHOLAR-1 标准的 ABCL 患者在缓解率和生存期方面的差异,比较了2个亚组内的市售产品 axi-cel 和tisa-cel,还分析了每个单独SCHOLAR-1标准的预后影响。

要点
在过去十年中,SCHOLAR-1研究确定了一组预后特别差的难治性侵袭性 B 细胞淋巴瘤患者,显示该人群的总生存期接近6个月。本文评估了 SCHOLAR-1 难治性标准对首次接受 CAR-T细胞治疗患者的影响,旨在证明这些标准如何对接受 CAR-T 治疗的患者结局产生负面影响。
当分析不同 CAR-T 产品对难治性标准的影响时,发现 axi-cel 在难治性患者以及非SHOLAR-1 难治性标准患者中的疗效均优于tisa-cel。tisa-cel在难治性人群中的结果明显较差。
整体来看,CAR-T 疗法显著改善了SHOLAR-1难治性人群的结果。在CAR-T时代单独评估SCHOLAR-1 标准中各变量,其中末线治疗难治是对生存期影响最显著的变量。
研究结果
患者特征
共329例患者接受了输注,其中169例接受axi-cel,160例接受tisa-cel。其中非SCHOLAR-1 组(不符合SHOLAR-1标准组)52例,SCHOLAR-1组277例(图1)。
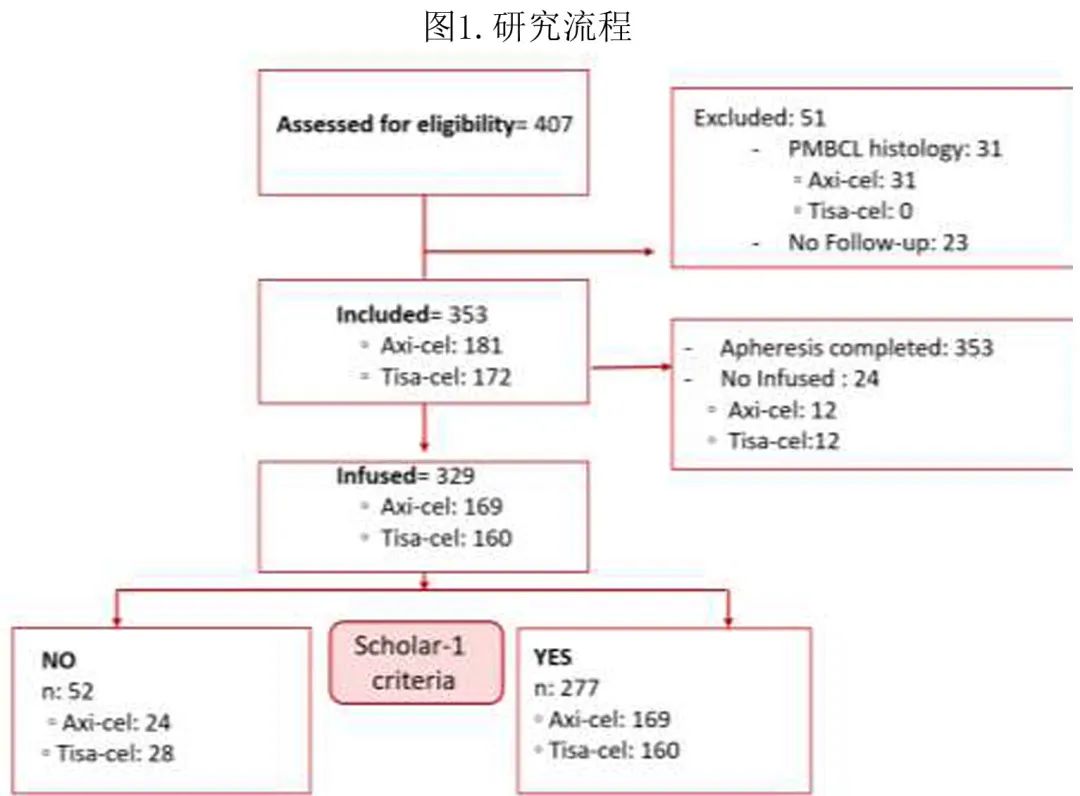
患者特征见表1。所有HGBCL病例均在 SCHOLAR-1 组 (n=38)。SCHOLAR-1 组和非 SCHOLAR-1 组在R-IPI、大包块疾病或造血细胞移植特异性共病指数 (HCT-CI) 方面无统计学显著差异。264例患者 (71%) 需要桥接治疗:71%(204) 为经典免疫化疗,6%(17)为R-苯达莫司汀-维泊妥珠单抗,15%(40)为放疗+/-化疗,4%(11)为类固醇 +/-单克隆抗体,3%(9)为靶向分子,SCHOLAR-1 组 (80%) 与非 SCHOLAR-1 组 (77%) 的桥接治疗频率无差异。SCHOLAR-1 组接受清淋且疾病稳定或进展的患者比例更高 (87% vs 75%,p=0.044)。
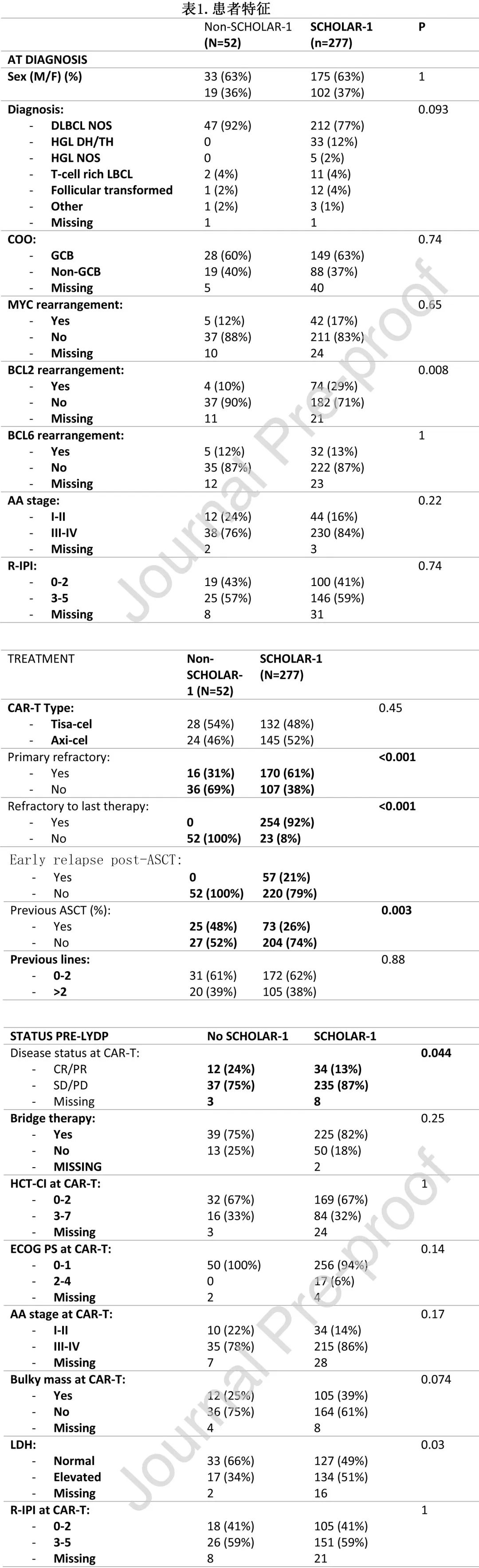
整体患者的疗效
整体人群中位随访时间为12.2个月,中位 OS 和 PFS 分别为15.4个月和3.5个月,估计的12个月 OS 和 PFS 分别为 56%和36%。在多变量分析中,CAR-T类型 (tisa-cel,HR=1.73,p = 0.001)、需要桥接治疗 (HR=1.81,p=0.008)、CAR-T时ECOG PS>1 (HR=1.97,p=0.013) 和末线治疗难治 (HR=2.23,p<0.001) 是 PFS 较差的独立预测因素。与 OS 较差相关的独立因素包括CAR-T 类型 (tisa-cel,HR=1.73,p=0.004)、需要桥接治疗 (HR=2.18,p=0.009)、单采时ECOG PS>1(HR=3.08,p=0.003) 和既往ASCT(HR=2.3,p<0.001)。
非SCHOLAR-1组的疗效
非 SCHOLAR-1 组的52例患者中24例输注axi-cel、28例输注tisa-cel。输注 axi-cel 或 tisa-cel 的患者在诊断、单采或 CAR-T 输注时无显著基线差异。中位随访12.2个月,中位 OS 和 PFS 分别为未达到和12.2个月,估计的12个月 OS 和 PFS 分别为 79%和56%。
表2为 OS 和 PFS 的单变量和多变量分析。
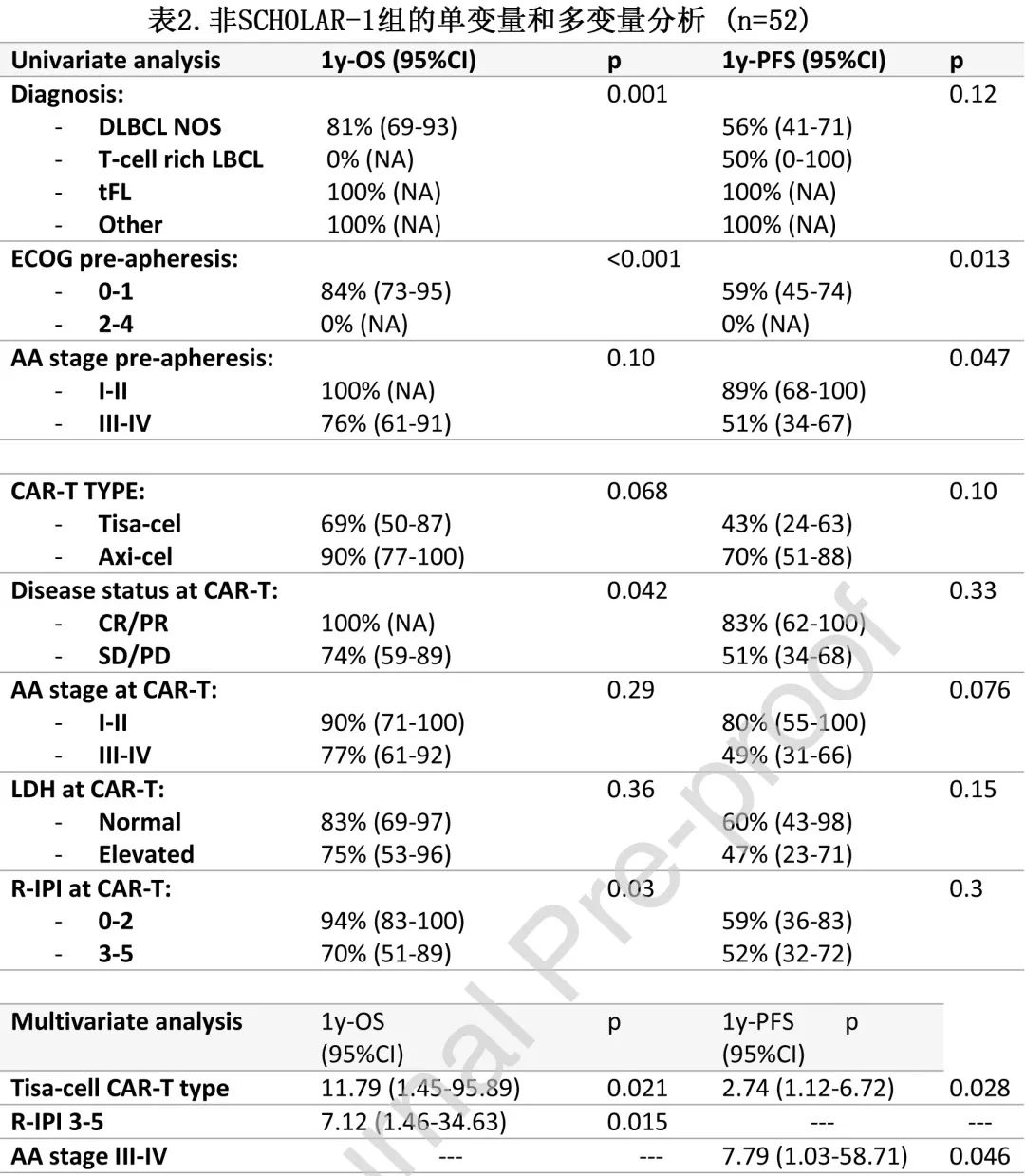
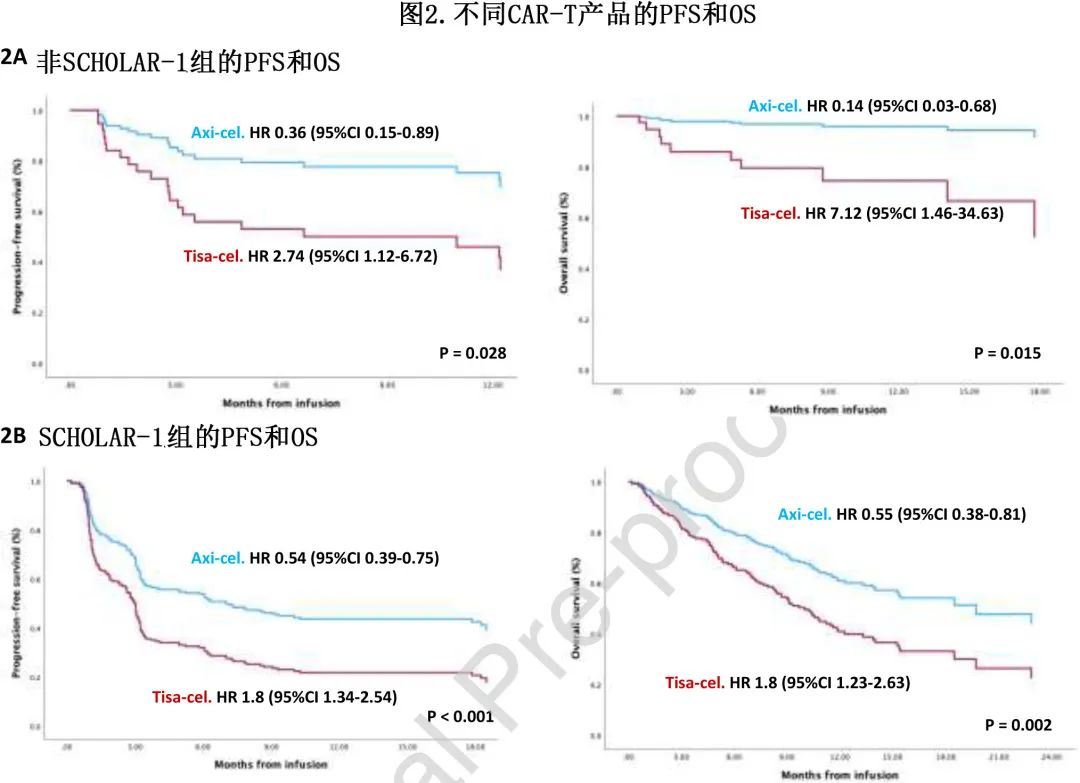
在多变量分析中,CAR-T 类型是OS(CAR-T tisacel:HR=7.12;p=0.015) 和PFS(CAR-T tisa-cel:HR=2.74 ;p=0.028)(图2A)的独立预后变量,单采前Ann Arbor III-IV 期是PFS 的独立预后变量(HR=7.79;p=0.046)和单采前 R-IPI 是OS的独立预后变量(HR=11.79;p=0.021)。(注:文字部分的两个HR,11.79和7.12与表2有差异,可能是表格错误)。
SCHOLAR-1组的疗效
SCHOLAR-1 组277例患者145例输注axi-cel,132例输注tisa-cel。与接受 axi-cel 治疗的患者相比,接受 tisa-cel 治疗的患者年龄更大,既往治疗更多,而axi-cel组中有更多患者在输注时存在巨大肿瘤。中位随访12.2个月,中位 OS 和 PFS 分别为13.3和3.3,估计的12个月 OS 和 PFS 分别为 52%和33%。表4为 OS 和 PFS 的单变量和多变量分析。
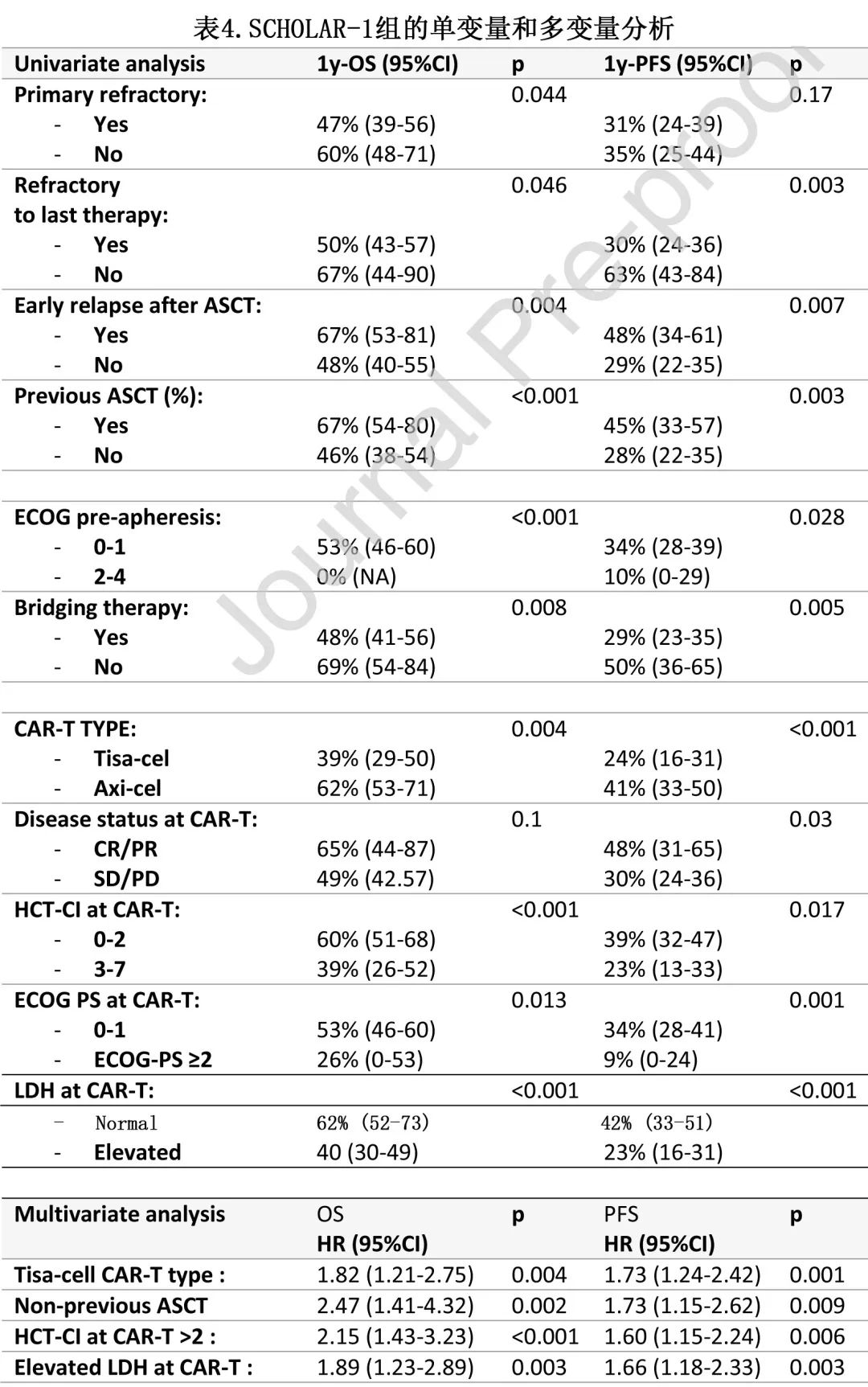
CAR-T类型是PFS(tisa-cel,HR=1.73;p=0.001) 和OS(tisa-cel,HR=1.82;p=0.004) 的独立预后变量(图2B)。独立影响 PFS 的其他变量包括:未接受ASCT(HR=1.73;p=0.009),CAR-T时的HCT-CI>2(HR=1.6;p=0.006)和 CAR-T 时 LDH 升高(HR=1.66,p=0.033)。独立影响OS的其他变量包括:未接受 ASCT(HR=2.47;p=0.002),CAR-T时HCT-CI>2(HR=2.15;p<0.001),CAR-T时 LDH 升高(HR=1.89,p=0.003)。
tisa-cel和axi-cel治疗的四个SCHOLAR-1和非SCHOLAR-1组的比较如图2C所示。
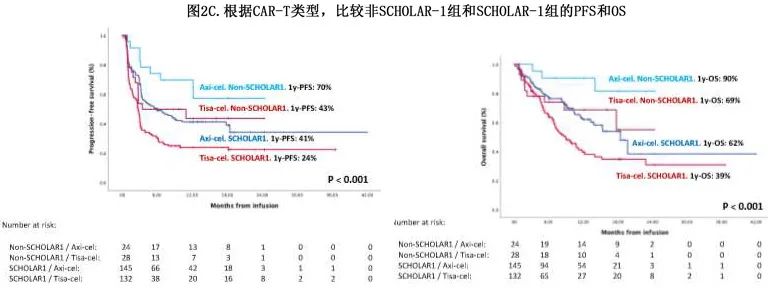
为了证实这些结果,以及考虑到 SCHOLAR-1 队列之间的不平衡,在全球队列中进行了倾向性评分分析,结果Axi-cel 在缓解率 (ORR 71% vs 57%,CR 52%v s 35%;p=0.018)、1年PFS(43% vs 24%,p<0.001) 和1年OS(63% vs 41%,p=0.008) 方面优于tisa-cel。
CAR-T时代的SCHOLAR-1标准
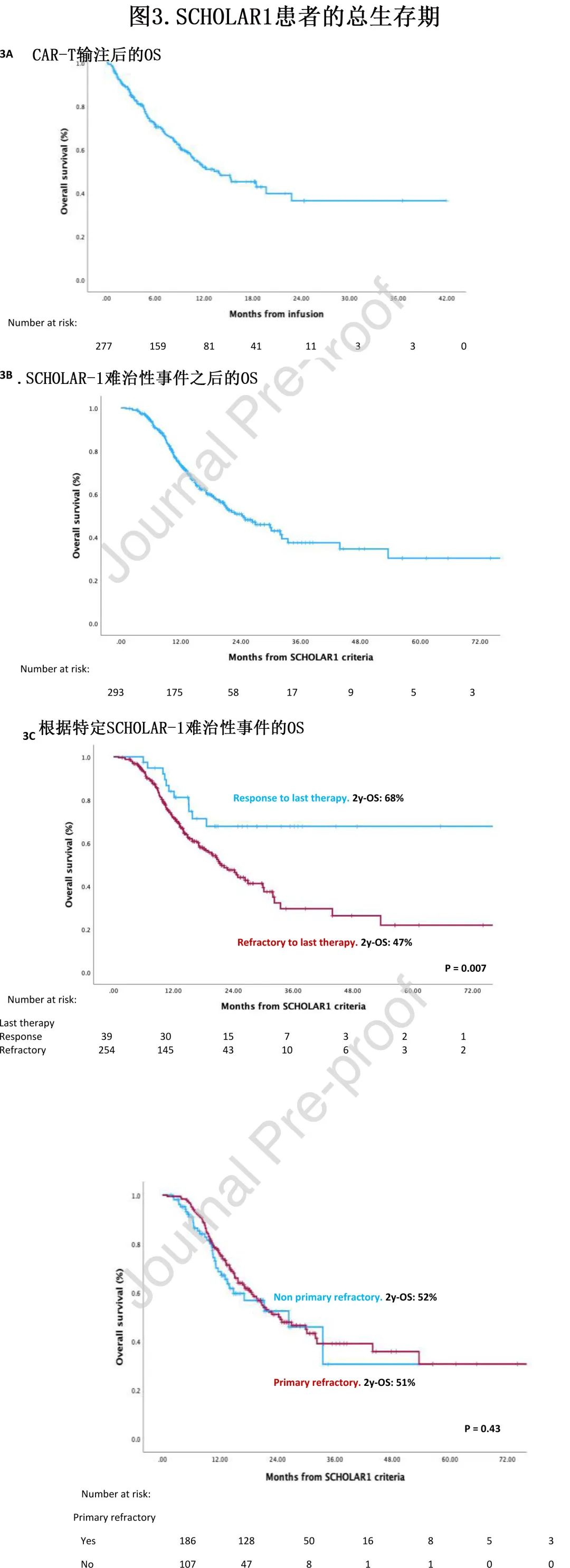
对于该分析,纳入了在任何时间符合任何 SCHOLAR-1 标准的所有患者(n=293)。CAR-T 输注后该组的中位OS(mOS) 为14个月,估计18个月 OS 为45%(图3A)。根据 SCHOLAR-1 难治性标准的表象进行分析时,中位 OS 为24个月,估计2年 OS 为51%(图3B)。在第二项分析中逐一分析 SCHOLAR-1 标准的变量,发现在 CAR-T 时代最影响生存期的变量是对末线治疗难治(对末线治疗的反应,未达到 mOS vs 对末线治疗无反应的mOS 为22个月(p=0.007)(图3C)。
毒性分析
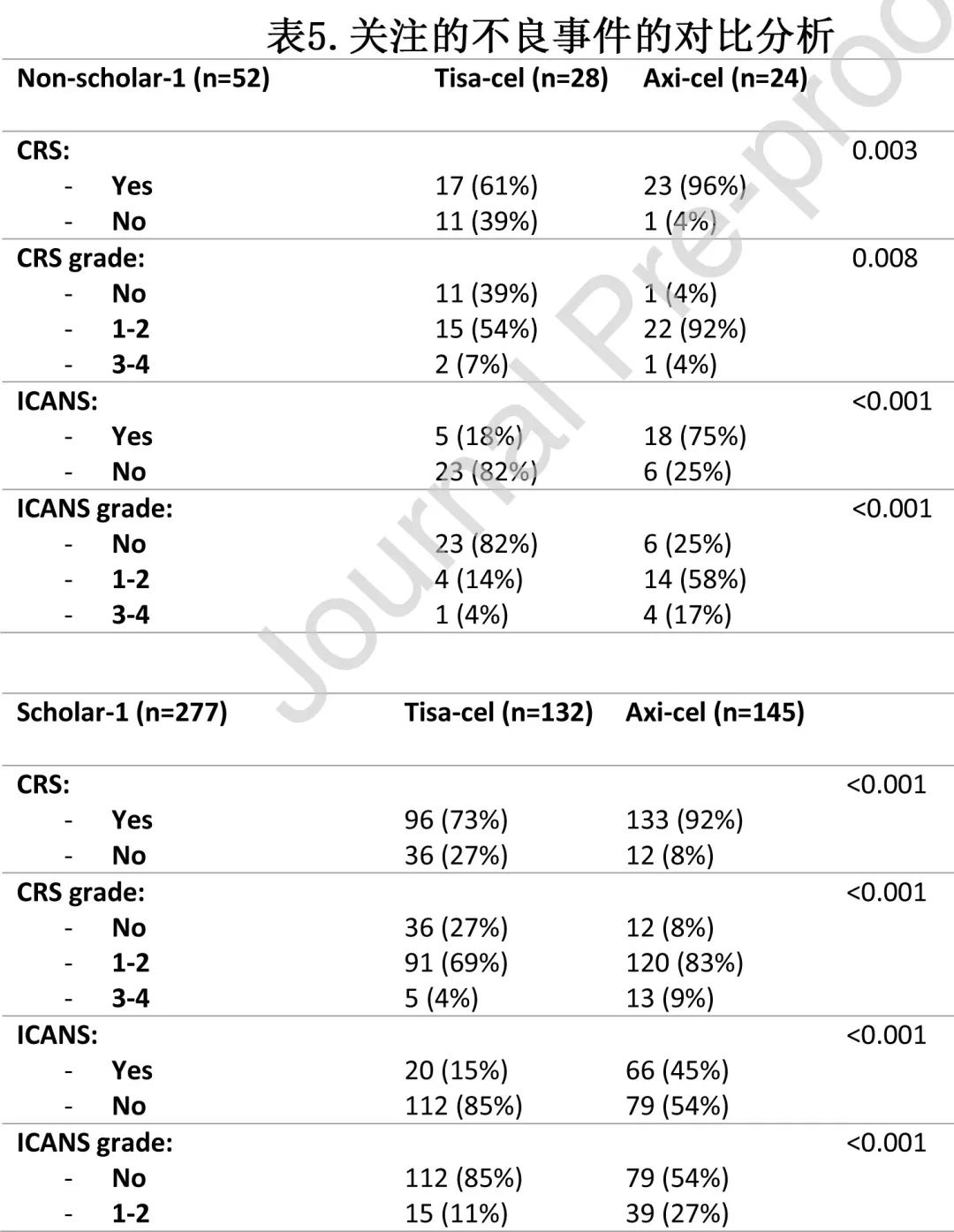
表5总结了特别关注的不良事件、CRS和免疫效应细胞相关神经毒性综合征 (ICANS) 的相关数据。在 SCHOLAR-1 和非 SCHOLAR-1 队列中,Axi-cel的毒性均高于tisa-cel。在多变量分析中,产品类型对总体CRS(CAR-T axi-cel,RR=4.89;p<0.001)、总体ICANS(CAR-T axi-cel,RR=5.57;p<0.001) 和重度ICANS(CAR-T axi-cel,RR=5.97;p<0.001) 保持独立影响。与重度 CRS 独立相关的其他因素为ECOG-PS≥2(RR=7.11;P=0.003) 和单采前大包块疾病 (RR=3.19;P=0.021)。tisa-cel 和 axi-cel 的非复发死亡率 (NRM) 分别为5%和7%(p=0.64);NRM 的诱因包括:tisa-cel:感染5例 (62%);CRS 1例 (12%)和未知2例 (25%);axi-cel:感染8例 (73%),ICANS2例 (18%) 和CRS1例 (9%)。
总结
在接受治疗的329例患者(169例 axi-cel 和160例tisa-cel)中,52例在非 SCHOLAR-1 组,277例在 SCHOLAR-1 组。发现非 SCHOLAR-1 患者的结局显著优于 SCHOLAR-1 患者(中位PFS分别为12.2个月和3.3个月;p=0.009)。此外,对于非SCHOLAR-1(PFS的HR=2.7,p=0.028;OS的HR=7.1,p=0.015)和 SCHOLAR-1 组(PFS的HR=1.8,p<0.001;OS的HR=1.8,p=0.002),axi-cel在疗效方面的结果均优于tisa-cel,但毒性也显著更大。最后,分别分析每个 SCHOLAR-1 标准的预后影响,发现对末线治疗难治是对生存期影响最显著的变量。
在这项回顾性分析中,作者分析了接受 CAR-T 细胞治疗的 ABCL 患者关于是否符合 SCHOLAR-1 标准的结局,既往尚无研究评估这些标准对 CAR-T 治疗人群的影响。多变量和倾向性评分分析的结果表明,与 tisa-cel 相比,axi-cel的疗效结果更好,但 SCHOLAR-1 和非 SCHOLAR-1 组的毒性均增加。此外与历史数据相比,CAR-T细胞时代 SCHOLAR-1 组的结局显著改善,并且发现末线治疗无效是与该组生存期相关的最关键因素。
参考文献
Oreiro MB,et al. Impact of SCHOLAR-1 criteria on CAR-T cell therapy efficacy in aggressive B lymphoma. A real-world GELTAMO/GETH study.Transplant Cell Ther . 2023 Aug 31;S2666-6367(23)01508-7. doi: 10.1016/j.jtct.2023.08.026.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











认真学习了
27