Nat Chem Biol:马骏/刘卓炜/梁晓雨/孙万阳团队揭示肿瘤再生细胞耐受铁死亡的机制
2024-05-12 iNature iNature 发表于上海
该研究使用软纤维蛋白凝胶培养系统,发现具有干细胞样癌细胞特征的肿瘤再生细胞(TRCs)通过降低铁死亡敏感性来抵抗化疗和放疗。
干细胞样癌细胞是否避免铁死亡介导治疗耐药尚不清楚。
2024年5月8日,中山大学刘卓炜、梁晓雨、马骏及暨南大学孙万阳(李哲、徐智敏、陈伟鹏及杜晓京为论文共同第一作者)共同通讯在Nature Chemical Biology 在线发表题为“Tumor-repopulating cells evade ferroptosis via PCK2-dependent phospholipid remodeling”的研究论文,该研究使用软纤维蛋白凝胶培养系统,发现具有干细胞样癌细胞特征的肿瘤再生细胞(TRCs)通过降低铁死亡敏感性来抵抗化疗和放疗。
在机制上,通过定量质谱和脂质组学分析,确定线粒体代谢激酶PCK2磷酸化并激活ACSL4,以驱动铁死亡相关的磷脂重塑。TRCs下调PCK2表达,使自身处于结构性铁死亡氧化状态。值得注意的是,除了在多个临床前模型中证实PCK2-pACSL4(T679)的作用外,在鼻咽癌队列中,较高的PCK2和pACSL4(T679)水平与更好的化疗和放疗反应以及较低的远处转移相关。

铁死亡的特征是铁依赖性脂质过氧化。越来越多的证据表明,铁死亡在肿瘤抑制中起着关键作用。肿瘤抑制基因(如P53)或免疫因子(如IFNγ)参与增强或诱导铁死亡,从而抑制肿瘤进展。重要的是,化疗、放疗和免疫治疗均可诱导铁死亡。干细胞样癌细胞(SCLCCs)是一种自我更新的、高度致瘤性的癌细胞亚群,它可以重新填充肿瘤,并且对多种治疗具有抗性,从而介导肿瘤复发。SCLCCs对各种治疗的抵抗主要是通过避免程序性死亡过程来逃避预定死亡。然而,SCLCCs是否避免铁死亡介导治疗耐药仍不清楚。
具体来说,在基于SH-SY5Y的神经母细胞瘤细胞系分化模型中,与分化的后代细胞相比,高干性的前体细胞对铁死亡具有抗性;同样,与心肌细胞相比,心肌细胞前体也表现出对铁死亡的抵抗力。相比之下,高表达CD44或经历上皮-间质转化的肿瘤细胞(这是来自某些组织(如乳腺、膀胱或结肠组织)的SCLCCs的特征)更容易发生铁死亡。因此,明确干细胞样肿瘤细胞与铁死亡敏感性之间的关系并探索其潜在机制至关重要。
磷脂(PL)不饱和程度是决定细胞对铁死亡易感性的关键因素。酰基辅酶A合成酶长链家族成员4 (ACSL4)催化多不饱和脂肪酸(PUFA)-CoA10的产生。活化的PUFA通过膜结合的O-酰基转移酶,特别是溶血磷脂酰胆碱酰基转移酶3 (LPCAT3)催化进一步整合到PLs中,随后进入细胞膜。此外,在真核生物中,转录后修饰,如ACSL4的磷酸化,对调节酶活性至关重要,不同的激酶或修饰位点可能导致相反的作用。有趣的是,一类特殊的激酶,如磷酸甘油酸激酶1 (PGK1)或丙酮酸激酶M2 (PKM2),通常作为代谢酶介导小分子代谢物的磷酸化,也可以作为蛋白激酶发挥作用,从而在代谢和信号转导之间产生强烈的串扰。虽然认为铁死亡主要受细胞内氧化还原平衡和代谢流转移的调节,但这是否通过代谢酶的非规范功能发生,还需要进一步阐明。
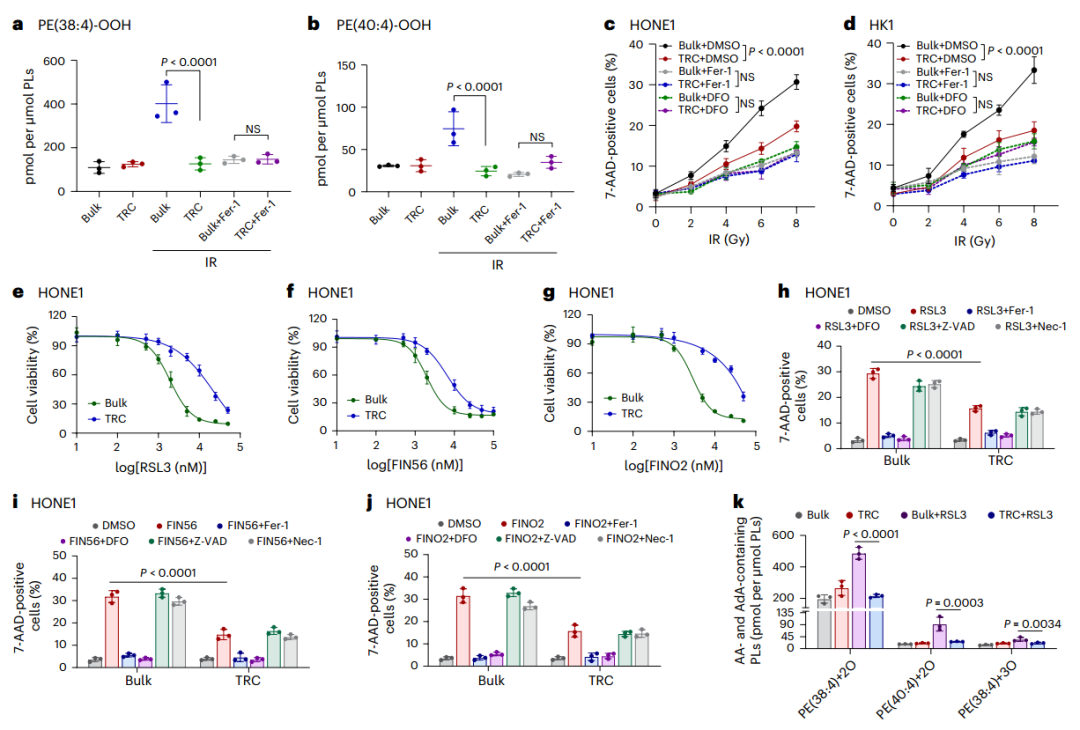
TRCs通过逃避铁死亡来抵抗放疗和化疗(图源自Nature Chemical Biology )
该研究采用基于生物力学力的三维(3D)软纤维蛋白凝胶培养系统获得肿瘤再生细胞(TRCs),并进一步探讨TRCs对化疗和放疗的耐药性是否与铁死亡敏感性有关。通过定量质谱分析、脂质组学/氧化还原脂质组学分析和基因编辑,揭示了线粒体磷酸烯醇丙酮酸羧激酶2 (PCK2)与ACSL4 T679磷酸化之间未被认识的联系。PCK2下调和ACSL4失活促进TRCs处于结构性铁死亡氧化状态。更值得注意的是,还验证了PCK2-pACSL4(T679)在体内肿瘤模型中的作用,并阐明了其在鼻咽癌(NPC)化疗和放疗队列中的临床相关性。
原文链接:
https://www.nature.com/articles/s41589-024-01612-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#铁死亡# #干细胞样癌细胞#
7