“中国关键”到来,MNC全球同步开发新药迈入新时代!
2019-12-24 药时代 药时代
全球同步开发药物是致力于新药研发的每一家中外企业和每一位研发人员的梦想,因为它可以最大幅度地造福全球的患者,也给企业带来最大程度的回报。但是,这在过去只是一个美丽的传说,一个诱人的幻想,因为,中国,这个拥有14亿人口和巨大的医患资源的国家因种种原因而“缺席”或“被缺席”。当2019年即将成为历史之时,寒冷的冬天里燃起了一把火,让人看到了希望,感到了温暖。这个“冬天里的一把火”是什么呢?2019
全球同步开发药物是致力于新药研发的每一家中外企业和每一位研发人员的梦想,因为它可以最大幅度地造福全球的患者,也给企业带来最大程度的回报。但是,这在过去只是一个美丽的传说,一个诱人的幻想,因为,中国,这个拥有14亿人口和巨大的医患资源的国家因种种原因而“缺席”或“被缺席”。当2019年即将成为历史之时,寒冷的冬天里燃起了一把火,让人看到了希望,感到了温暖。这个“冬天里的一把火”是什么呢?

2019年12月12日,双12这一天,拥有134年悠久历史的德国制药公司勃林格殷格翰宣布公司已启动“中国关键”(China Key)项目,将中国全面纳入全球早期临床开发项目。“创新展现价值!“以此为宗旨的勃林格殷格翰开行业之先河,成为跨国药企(MNC)中第一个将中国全面纳入全球早期临床开发项目的公司。这一项目的实施,将不仅加速公司研发管线中创新产品在中国的注册,也将为中国患者提供更早参加最前沿在研药物临床试验的机会,为这些患者带来更多生存和健康之希望。
药物研发是一次漫漫长征,是一场“西游记“,充满艰难险阻,研发者需要证明药物的安全性和有效性,为此承受周期长、高投入、高不确定性等问题和风险。在中国,注册一个药物需要提供该药物在中国人群中的临床试验数据,以确认该药物对中国患者安全而有效。如果在全球试验结束后再单独在中国做试验,那么该药物在中国提交注册申请和获批的时间会大大晚于其他国家。过去的几十年里,创新药在中国的上市时间比欧美国家和地区晚5~7年不足为怪。因此,将中国纳入全球临床试验将极大地加速药物在中国的上市时间。但是,为了达到这一目标,中国需要具备足够的软件和硬件,打铁还需自身硬,也需要我们常说的“天时地利人和“。近年来,中国政府出台了一系列加速创新药物在中国做临床试验及获批上市的政策,让中国加入全球早期临床开发项目成为可能。2018年7月27日国家药品监督管理局发布的《国家药品监督管理局关于调整药物临床试验审评审批程序的公告(2018年第50号)》,就是一个最好的例子。
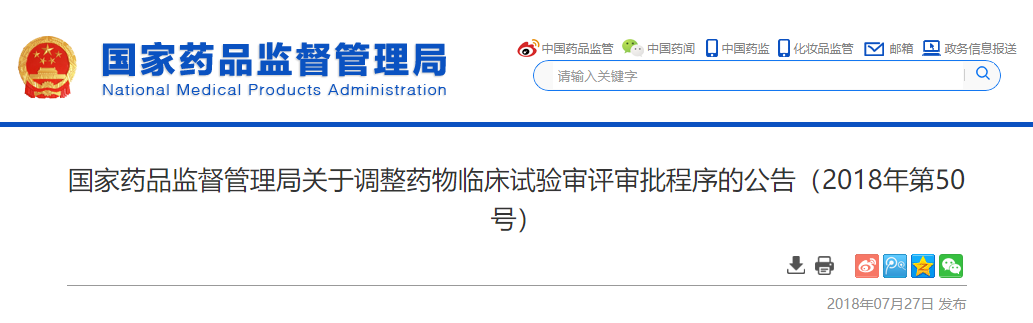
为鼓励创新,加快新药创制,满足公众用药需求,落实申请人研发主体责任,依据中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),对药物临床试验审评审批的有关事项作出调整:在中国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心否定或质疑意见的,可按照提交的方案开展药物临床试验。
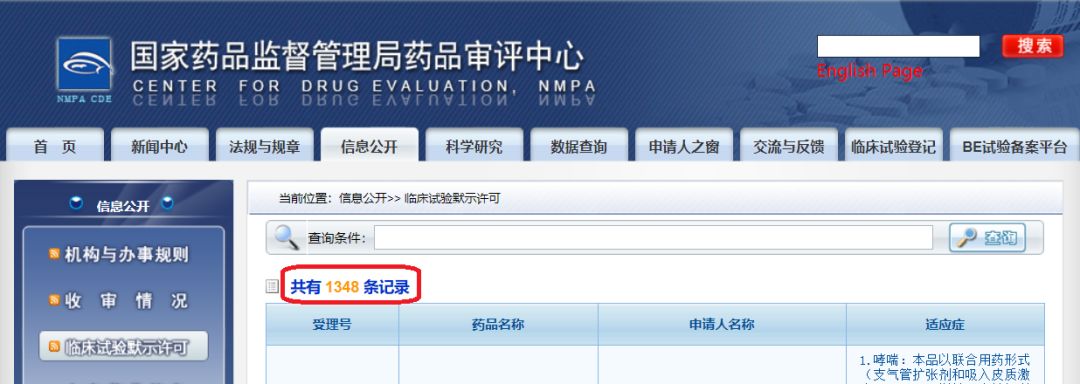
这就是著名的50号令,解决了中国新药开发过程中的一个大瓶颈,大大加快了新药开发的速度。这个改革政策得到了国内外企业、行业极大的的关注和称赞。截止2019年12月14日,共有1348个临床试验获得“绿色通道“待遇,对新药研发产生了非常大的推动作用。
而中国加入ICH也意义重大。2017年6月中国国家食品药品监督管理总局(现在为国家药品监督管理局,NMPA)作为正式监管成员加入国际人用药品注册技术协调会(ICH,International Council for Harmonization)。ICH是药物研发企业、监管机构的专家以及患者等共同参与的一个平台,旨在协调不同国家间有关药品质量、安全性和有效性的技术规范,推动药品注册要求的一致性和科学性。中国药监部门加入ICH成为其正式成员,意味着包括药品监管机构、临床试验单位等在内的中国的医药行业加入全球药物开发这个重要的“朋友圈“,与经验丰富的小伙伴儿们合作,以药品质量、疗效、安全性的国际最高标准要求自己,肩上的责任更加重大。加入ICH后,NMPA需要在国内首先逐步实施和转化已经达成的技术指南,与此同时参与全球技术指南的制定。这意味着,中国的药品注册标准将逐步全面与国际接轨,中国的药品注册进入全球化时代。因为中国已将监管的重点重新集中到创新疗法和器械的快速批准上,MNC公司成为主要受益者。这些改革措施除了使中国,全球第二大市场,变得更加可及之外,对行业产生的更深远影响在于,中国的政策调整和新兴的全球角色为未来的全球临床开发和监管战略指明了一种新的令人振奋的新格局。
作为一家不上市的MNC,勃林格殷格翰于1994年3月以办事处的形式正式进入上海,开启了激动人心的中国发展篇章。二十五年来,勃林格殷格翰在广袤的中国大地上快速发展,速度超过市场平均增长速度,是国内跨国药企中增长最快的企业之一。目前勃林格殷格翰大中华区总部设置在上海,业务遍布全国,在4500多名员工的努力之下,人用药品、动物保健、生物制药、创新解决方案几大业务板块并驾齐驱,协调发展,推动公司持续增长。中国已成为勃林格殷格翰最重要的战略市场之一。
勃林格殷格翰一直致力于为中国患者带来更多创新药物并将中国患者的需求纳入全球研发策略。因此自2009年以来,勃林格殷格翰中国就开始努力争取让中国加入全球试验。期间经历了China I、China II和China III项目。2018年3月公司启动China IN(中国纳入)项目,一个加快新药在中国研发上市的项目。这个项目的目标是中国默认参加全球注册临床研究,把中国患者纳入到这些国际多中心注册临床研究项目中来,同步累积更多中国患者的循证医学数据。随着该项目的实施,中国将参与所有全球注册临床试验,从此跻身全球第一批递交新药注册申请的国家,与美国、欧盟、及日本同步。2019年6月勃林格殷格翰在中国递交了尼达尼布用于治疗系统性硬化病相关间质性肺疾病(SSc-ILD)的注册申请,这是公司首次实现在中国与美国和欧盟同步递交;12月份在中国又递交了尼达尼布用于治疗进展性纤维化性间质性肺疾病(PF-ILD)的注册申请,再次实现与美国和欧盟同步递交。
通过“中国纳入”项目,勃林格殷格翰所有全球新药的三期临床研究项目都已经把中国患者纳入其中。截止2019年底,约有76项临床研究在中国进行,涉及卒中预防、呼吸系统、糖尿病、肿瘤领域超过3.7万名患者。除了把中国纳入到国际多中心临床研究项目以外,勃林格殷格翰还希望在未来能够专门针对中国人的疾病谱进行专门的临床研究项目。
如今,China IN升级为China Key,意味着中国将不仅参与全球注册临床试验,也将默认参与所有的早期临床试验,公司创新药物在中国上市有望进一步加速,甚至早于欧美。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#MNC#
39
#新时代#
59