前沿进展 | 激活淋巴细胞亚群:新型癌症疫苗有望成为肿瘤终结者
2023-12-07 上海阿克曼病理 上海阿克曼病理 发表于上海
该文章同时指出,该新型疫苗疗效是由NK细胞和CD4+ T细胞介导的。因此,基于淋巴细胞亚群的NK细胞和CD4+ T细胞绝对值计数显得尤为重要。

着眼于“kill me”信号,通用型癌症疫苗诞生
当正常细胞遭受 DNA 损伤时,它们会在其外表面上表达一种蛋白质,向淋巴细胞亚群中的成员传递“kill me”信号,从而使免疫系统前来消灭被标记的细胞。然而,一些癌细胞已经可以将这些蛋白质从它们的表面上脱落,从而使它们能够逃避免疫系统的追杀。
以前,绝大多数其他癌症疫苗必须针对每个患者进行个性化定制,因为它们旨在针对患者肿瘤表面的特定分子。相比之下,这种新型疫苗可以“通用”,无需等待和昂贵的个性化定制,因为“kill me”蛋白质存在于大多数细胞类型中。此外,由于它可以同时募集 T 细胞和 NK 细胞,因此它可以有望用于治疗对其他癌症疫苗有耐药性的癌症。
该文章同时指出,该新型疫苗疗效是由NK细胞和CD4+ T细胞介导的。因此,基于淋巴细胞亚群的NK细胞和CD4+ T细胞绝对值计数显得尤为重要。
MICA/B应激蛋白:肿瘤疫苗的主角
大多数癌症疫苗以多肽抗原为目标,由于将多肽呈递给T细胞的主要组织相容性复合物(MHC)分子存在巨大的个体差异,因此需要进行个性化定制。此外,肿瘤经常通过干扰多肽呈递的机制逃避T细胞介导的免疫。因此,研究团队开发了一种概念上的新型癌症疫苗,以肿瘤免疫逃逸机制为目标。该疫苗针对MICA和MICB (MICA/B)应激蛋白,这些蛋白在许多类型的人类癌症中对DNA损伤做出反应时上调,但在健康细胞中表达水平较低或无法检测到。通过膜结合MICA/B激活NKG2D受体,触发自然杀伤(NK)细胞的细胞毒性程序和CD8+ T细胞的共刺激信号通路。然而,许多人类肿瘤通过蛋白水解使细胞表面MICA/B脱落来逃避这一重要的免疫识别途径。脱落实质上减少了这些NKG2D受体的免疫刺激配体在肿瘤细胞上的表面密度。据报道,脱落的MICA/B蛋白也可诱导NKG2D受体内化作用并抑制NK细胞功能。研究发现,自体细胞基础癌症疫苗(GVAX)加抗CLTA-4可使黑色素瘤患者产生抗MICA抗体,这些抗体的存在与血清中脱落MICA水平的降低以及CD8+ T细胞和NK细胞反应的增强相关。
刻意采用MICA/B的α3结构域的疫苗设计
研究团队的疫苗针对MICA/B高度保守的α3结构域,即蛋白水解脱落的位置,设计用于通过T细胞和NK细胞诱导肿瘤免疫(图1a)。研究团队有意绕过了α1 -α2结构域,以避免诱导抗体阻断NKG2D受体结合。疫苗抗原的多价展示极大地增强了免疫原性,因此研究团队将MICB或MICA的α3结构域融合到幽门螺杆菌铁蛋白的N端,形成由24个亚基组成的颗粒(扩展数据图1a-c)。所有实验均以铁蛋白作为对照抗原。新研发的介孔二氧化硅棒(MSR)生物可降解支架结合粒细胞-巨噬细胞集落刺激因子(GM-CSF,用于树突状细胞(DC)增殖)和CpG ODN 1826(佐剂)被用于疫苗的输送。
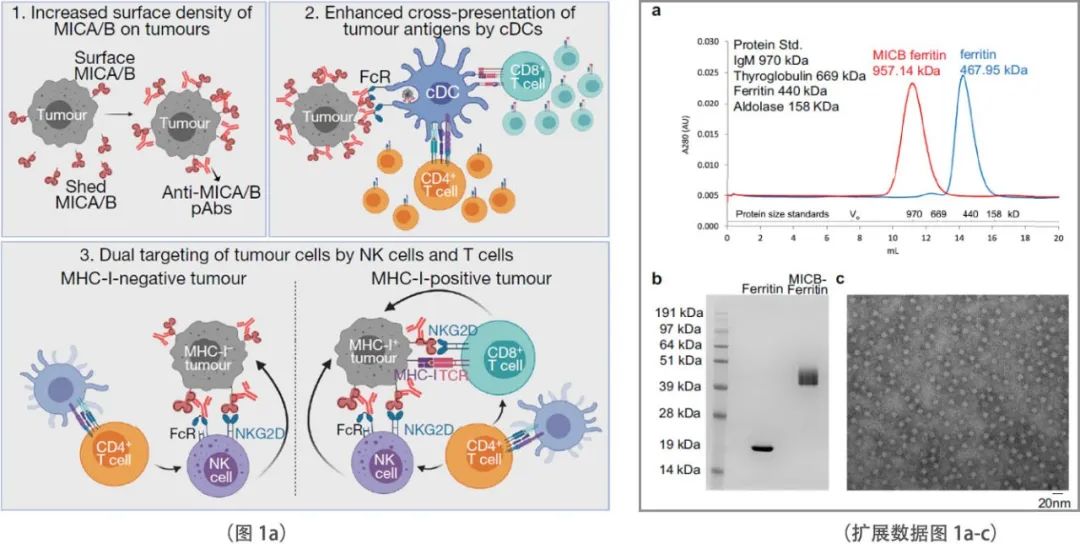
转移性肿瘤的克星
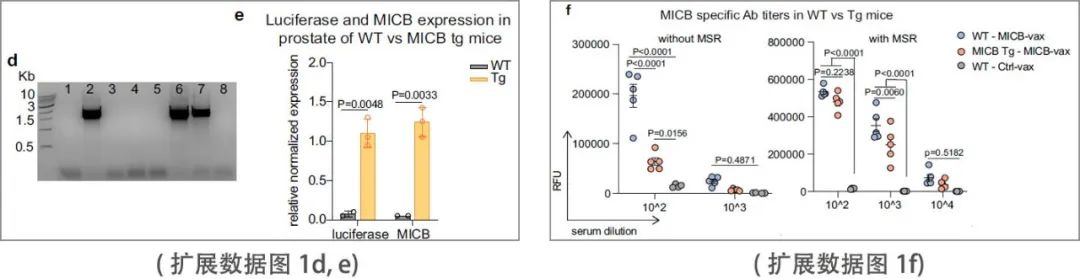
小鼠NKG2D受体与人MICA/B蛋白结合,但小鼠NKG2D配体与人MICA/B的同源性有限。因此,研究团队在小鼠癌细胞系中表达人MICB或MICA蛋白进行体内实验。人类MICA/B蛋白由这些小鼠癌细胞系脱落,类似于人类癌细胞。MICB转基因小鼠的免疫接种实验显示,MICB 和荧光素酶的报告基因在前列腺特异性probasin启动子的控制下表达。通过逆转录qPCR证实了MICB和荧光素酶mRNA在前列腺中的表达(扩展数据图1d, e)。在没有MSR支架的情况下,用MICB-铁蛋白免疫后,MICB转基因小鼠的抗体滴度明显低于野生型(WT)小鼠。为这些转基因小鼠对MICB的部分耐受提供了证据。MSR支架的加入大大增加了两种菌株的抗体滴度,能够在部分耐受的 MICB 转基因小鼠中诱导高滴度抗体(扩展数据图1f)。
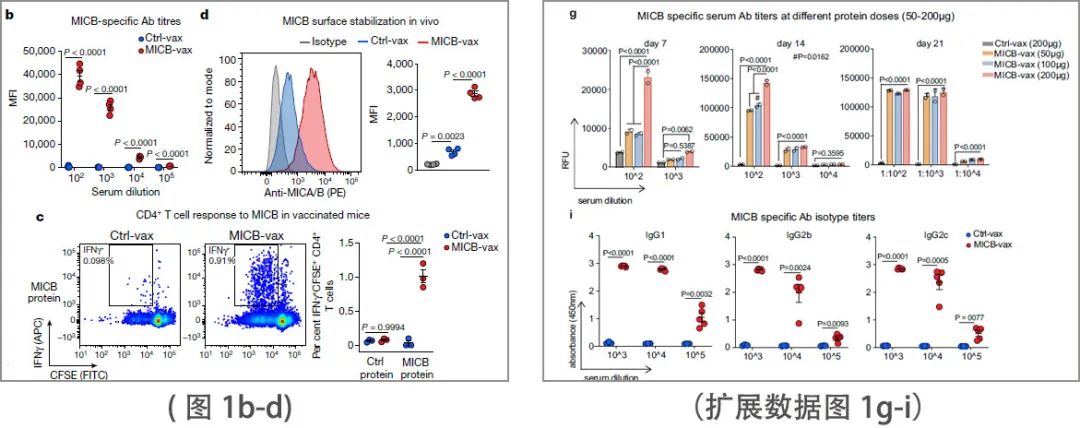
MICB α3域疫苗(MICB-vax)能诱导高滴度抗体来强标记B16F10 (MICB)肿瘤细胞(表达人MICB),但不能控制B16F10肿瘤细胞(图1b和扩展数据图1g-i)。该疫苗还诱导CD4+ T细胞和CD8+ T细胞对MICB产生应答。正如预期的那样,MICB α3 结构域特异性抗体不干扰人或小鼠 NKG2D 受体与 MICB 的结合。少量的MICB接种小鼠的血清通过抑制MICA/B脱落显着增加人和小鼠癌细胞系的细胞表面MICA/B蛋白水平。在体内,MICB-vax抑制MICB脱落至无法检测的水平,并显著增加了B16F10肿瘤上MICB的细胞表面密度(图1d)。
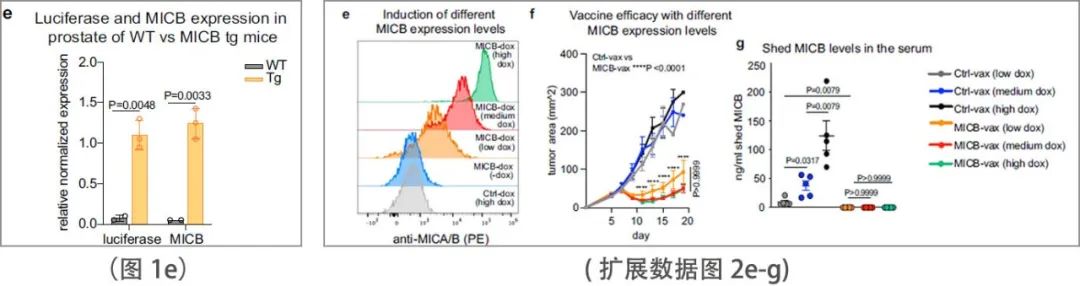
该疫苗在控制表达MICB或MICA的B16F10和EL4皮下肿瘤方面显示了显著的有效性(图1e和扩展数据图2k - n)。为了评估由 MICB-vax 诱导的免疫记忆,在初始免疫 4 个月后,用 B16F10 (MICB) 肿瘤细胞再次攻击未受肿瘤影响的小鼠,并发现它们受到了完全保护(扩展数据图2j)。在使用强力霉素诱导启动子诱导的同基因肿瘤模型中,在各种MICB表达水平上均观察到了疫苗的有效性(扩展数据图2e-g),包括MICB低表达的肿瘤细胞。此外,该疫苗对由单个克隆或多个克隆组成的B16F10 (MICB)细胞系显示出相似的疗效。
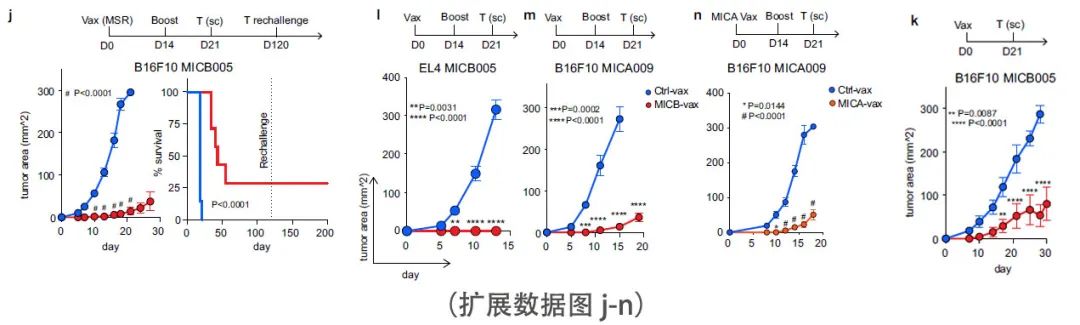
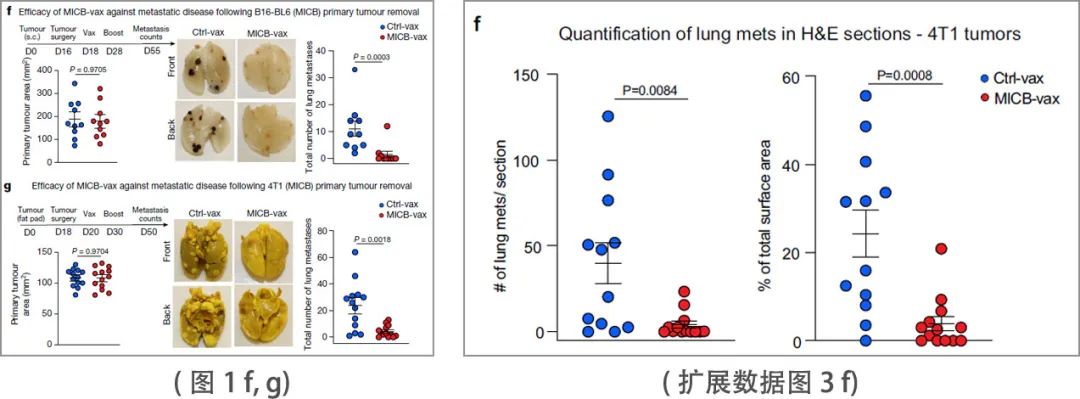
NK细胞和T细胞在控制转移中都起着关键作用。肿瘤学中最具挑战性的问题之一是许多局部晚期肿瘤患者已经发生微转移,尽管原发肿瘤已被切除,但仍会复发。因此,研究团队评估了MICB-vax在这一具有挑战性的环境中的疗效,方法是在手术切除原发肿瘤后对具有较高早期转移性传播倾向的小鼠进行免疫接种。研究团队使用了两种自发转移模型,B16-BL6 (MICB)黑色素瘤模型和4T1 (MICB)三阴性乳腺癌模型。在切除原发肿瘤后,小鼠接受MICB-vax或Ctrl-vax(铁蛋白)治疗。在这个治疗设置中, MICB-vax显著减少了手术后1个多月后两种模型中检测到的肺转移瘤数量(图1 f, g)。肺切片的组织学分析进一步表明,与 Ctrl-vax 相比,MICB-vax显着减少了转移数量和大小 (扩展数据图3 f)。
对耐药型肿瘤也具有强大杀伤力
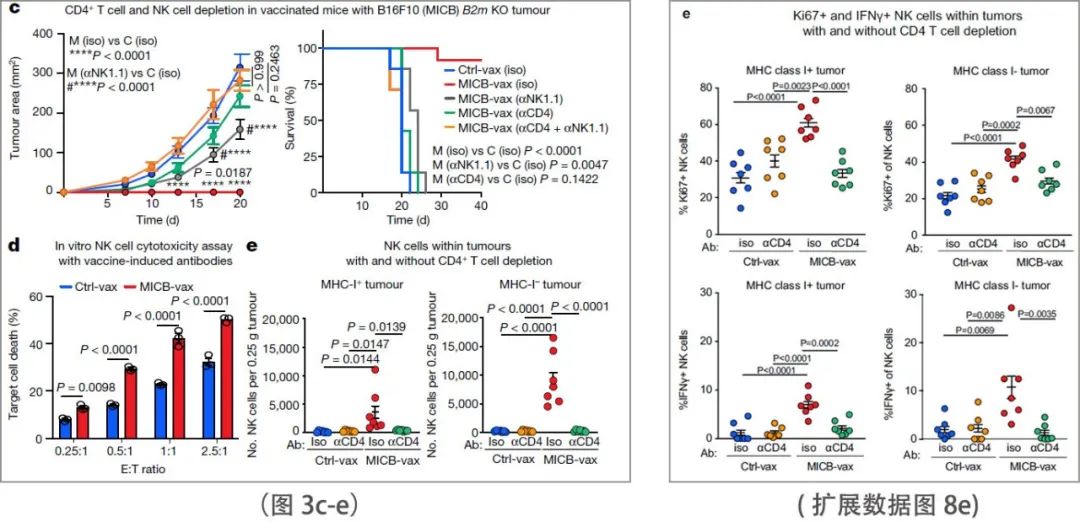
细胞耗尽实验表明,CD4+ T细胞对MICB疫苗的有效性至关重要;CD8+ T细胞或NK细胞的减少,以及NKG2D受体阻断也会降低MICB-vax所赋予的生存优势(图2m和扩展数据图8a)。IFNγ的中和消除了MICB疫苗对抗B16F10 (MICB)肿瘤的保护作用(扩展数据图8b)。因此,多效应细胞群和效应机制在很大程度上促进了MICB疫苗的功效。
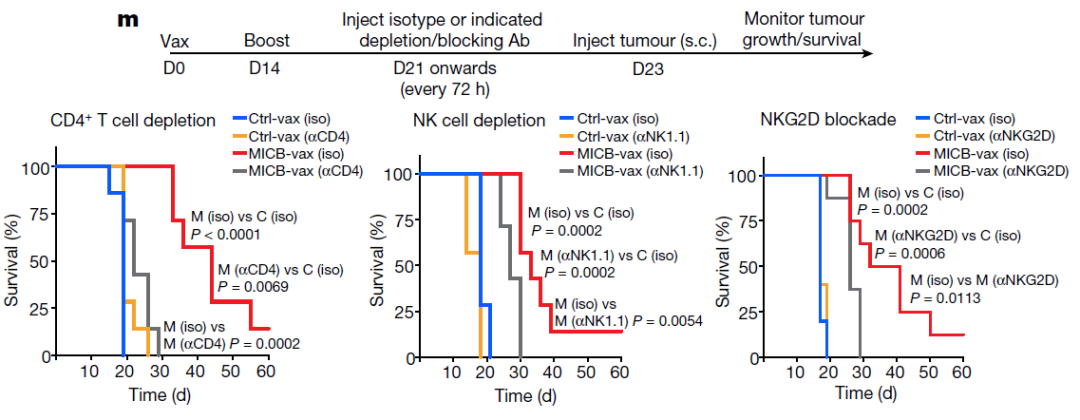
(图2m)
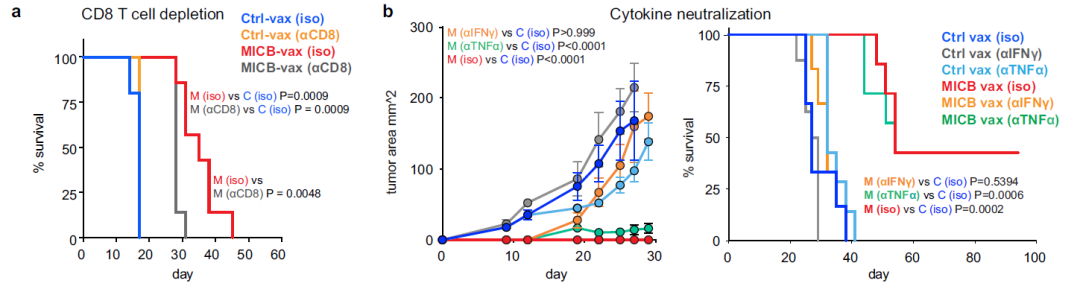
(扩展数据图8a-b)
对当前免疫治疗的耐药性通常是由MHC-I抗原呈递或IFNγ信号通路中的基因失活突变(或下调)介导的,这些基因极大地损害了CD8+ T细胞介导的肿瘤免疫。研究团队的理论认为MICB-vax可能对这种耐药肿瘤有效,因为它诱导了包括了大量NK细胞在内的多个效应细胞群的募集。事实上,研究团队发现MICB-vax对突变导致MHC-I (B2m - / -)、MHC-II (H2-Aa - / -)或IFNγ受体(Ifngr1 - / -)表达缺失的B16F10 (MICB)肿瘤有效,50-75%的小鼠在100天后仍然没有肿瘤。细胞耗尽实验证明,在MICB-vax免疫小鼠中,需要CD4+ T细胞和NK细胞来有效控制B2m - / -肿瘤(图3c)。当给予 CD4+ T 细胞消耗性单克隆抗体时,这些小鼠已经具有高滴度的抗 MICB 抗体,并且抗体滴度不受 CD4+ T 细胞消耗的影响。MICB-vax免疫小鼠的纯化血清IgG能在体外实现NK细胞介导的对B2m - / - B16F10 (MICB)肿瘤的强效杀伤。与接受了Ctrl-vax的对照组相比,MICB-vax免疫小鼠的B2m - / - B16F10 (MICB)和B16F10 (MICB)肿瘤中NK细胞(包括IFNγ+和Ki67+细胞)的积累显著增加。CD4+ T细胞减少导致瘤内NK细胞数量显著减少(图3e和扩展数据图8e)。以上数据表明,MICB疫苗对耐药肿瘤(B2m - / -和Ifngr1 - / -)的疗效是由NK细胞和CD4+ T细胞介导的,CD4+ T细胞在NK细胞募集到肿瘤中起重要作用。
淋巴细胞亚群是实现肿瘤免疫的关键
该疫苗设计通过淋巴细胞亚群(包括不同的T细胞和NK细胞群)实现肿瘤免疫。疫苗诱导抗体抑制了肿瘤细胞的蛋白水解MICA/B脱落,增强了NK细胞的细胞毒性功能,并增加了常规树突状细胞1(cDC1)介导的肿瘤抗原对CD8+ T细胞的交叉呈递。该疫苗还诱导CD4+和CD8+ T细胞对MICA/B的反应,以及对疫苗中未包含的黑色素瘤抗原的表位扩散(即原本靶向特定的抗原,结果引发对更多抗原的免疫反应)。通过常见的逃逸机制,包括MHC-I表达或IFNγ受体信号通路的丢失,多效应细胞群的参与能够诱导对抗肿瘤的保护性免疫。疫苗诱导的针对 MHC-I 缺陷型肿瘤的免疫是通过 CD4+ T 细胞和 NK 细胞的协同作用介导的。这项工作的一个限制是人类 MICA/B 蛋白必须在小鼠肿瘤细胞中表达,因为小鼠 NKG2D 配体与 MICA/B 的同源性有限。这种方法需要在癌症患者的临床试验中进行评估,目前正在计划进行首次人体临床试验。血清中的脱落MICA/B水平和肿瘤细胞的MICA/B表达将作为患者选择的主要生物标志物。这种疫苗也可能与局部放疗联合使用,因为DNA损伤会增强癌细胞MICA/B的表达。
淋巴细胞亚群:对肿瘤临床治疗具有重要指导意义
免疫功能的状态与肿瘤的发生、发展和预后密切相关。通过对淋巴细胞亚群的分析,能够精准地评价病人的免疫功能,为肿瘤的临床诊治、预后判断提供参考。在另一篇文献中,淋巴细胞亚群检测这一简便易行的临床检验手段可以有效评估非小细胞肺癌患者的免疫损伤状态,并指导预后,包括:
-
肿瘤患者免疫功能受损体现为淋巴细胞各亚群绝对计数下降。
-
患者的淋巴细胞绝对计数下降与肿瘤分期密切相关。
-
手术和化疗可不同程度的加重NSCLC患者免疫功能损伤。
-
CD4+细胞绝对计数是预测NSCLC患者预后的独立因素。
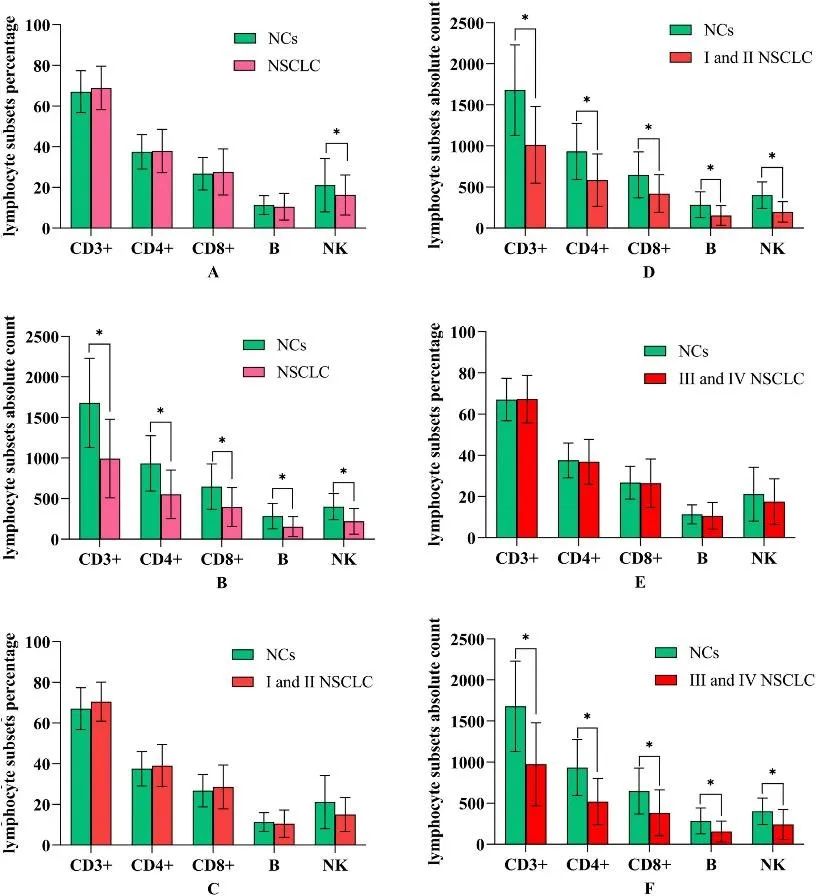
(健康志愿者与NSCLC患者的淋巴细胞亚群百分比和绝对计数)
参考文献:
[1] Nature. 2022;10.1038/s41586-022-04772-4. doi:10.1038/s41586-022-04772-4.
[2] Transl Oncol. 2020;13(12):100849. doi:10.1016/j.tranon.2020.100849
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#癌症疫苗# #淋巴细胞亚群#
45