中国药科大学姜虎林教授《Biomaterials》:一种具有GSH消耗和DHODH抑制功能的白蛋白纳米药物有效治疗三阴性乳腺癌
2023-12-29 BioMed科技 BioMed科技 发表于上海
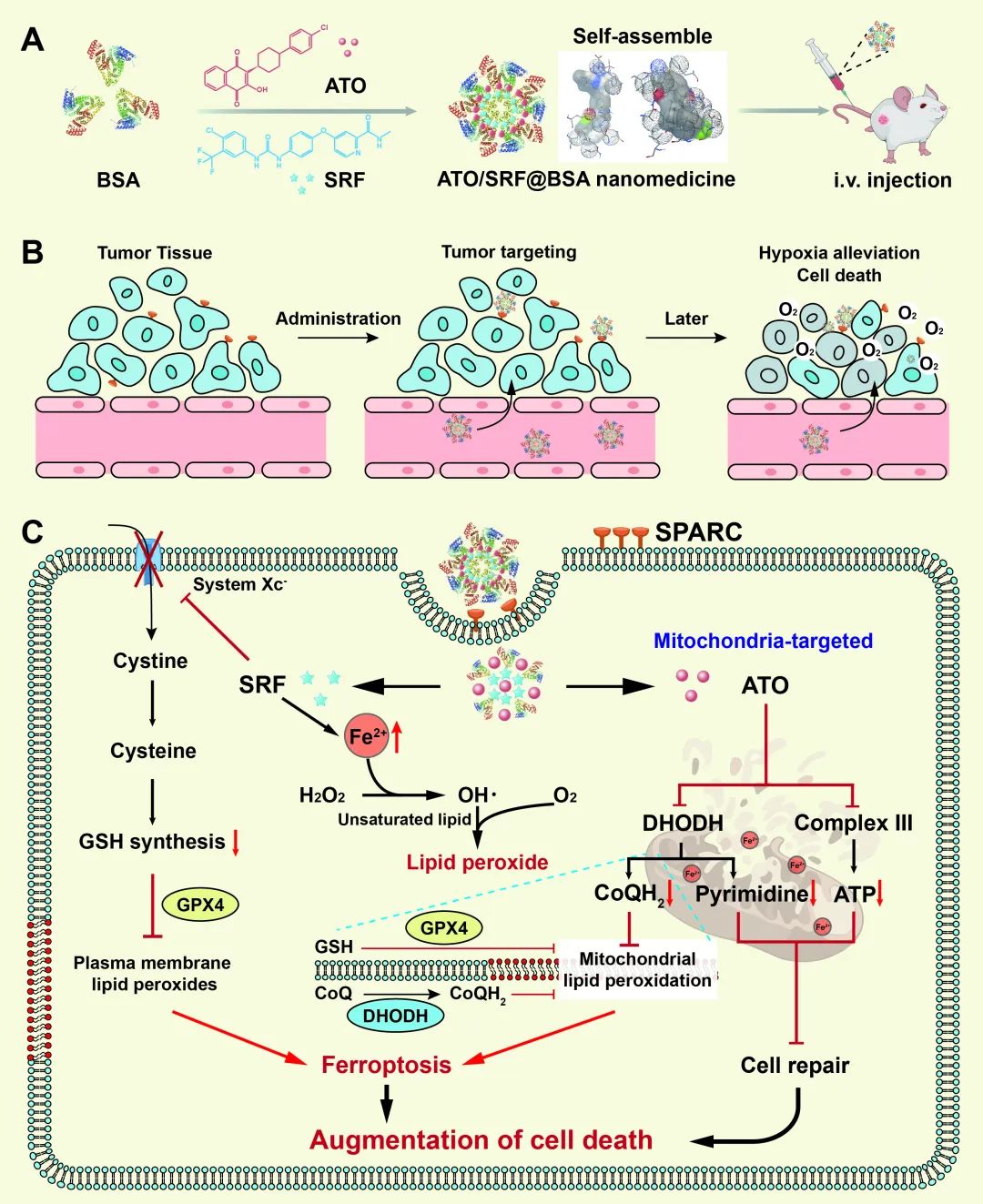
近期,中国药科大学姜虎林教授课题组聚焦于铁死亡的关键通路和细胞代谢的中心线粒体,设计了一种具有GSH消耗和DHODH抑制功能的白蛋白纳米药物ATO/SRF@BSA。
【铁死亡——治疗三阴性乳腺癌的新型有力策略】
三阴性乳腺癌(TNBC)高复发、易转移、难治疗,预后较其他类型差,生存期较短,成为乳腺癌治疗的一大难题,迫切需要开发新的药物和治疗策略。铁死亡作为一种新发现的细胞程序性死亡形式,由脂质过氧化物堆积造成脂质膜破裂引起。铁死亡区别于细胞凋亡、细胞坏死、细胞自噬,对常规疗法耐药或具有高转移潜力的癌细胞可能表现出更高的铁死亡易感性,为TNBC的治疗提供了一种很有前途的策略。
然而,癌细胞所具有的多重铁死亡防御途径,极大地阻碍了铁死亡的治疗效果,包括胞质和线粒体中GSH-GPX4系统以及质膜上FSP1-CoQ系统等。近期研究发现,严重的 GPX4 抑制能够反馈性引起二氢乳清酸脱氢酶 (DHODH) 含量显著增加,导致还原态的泛醌 (CoQH2) 的合成增加,用于抵抗线粒体内的脂质过氧化以防御铁死亡。因此,同时耗竭GSH并抑制DHODH可能为TNBC提供一种新的治疗策略。
【文章要点】
近期,中国药科大学姜虎林教授课题组聚焦于铁死亡的关键通路和细胞代谢的中心线粒体,设计了一种具有GSH消耗和DHODH抑制功能的白蛋白纳米药物ATO/SRF@BSA。利用白蛋白负载索拉非尼和阿托伐醌用于增强铁死亡治疗效果,其中索拉非尼降低胞内GSH含量,扰乱胞内不稳定的铁池,促进Fe2+向线粒体转移,触发铁死亡。阿托伐醌可降低线粒体中DHODH活性,阻滞还原性CoQH2的生成,打破线粒体抵抗铁死亡机制,进一步促进线粒体和细胞质中脂质过氧化物的爆发性产生,驱动铁死亡快速进行以治疗三阴性乳腺癌。这项研究中提出的基于白蛋白的纳米药物因其简单性而引人注目,并有望产生显著的抗癌效果,并为 TNBC 的治疗提供新的策略。相关工作以“Glutathione depletion and dihydroorotate dehydrogenase inhibition actuated ferroptosis-augment to surmount triple-negative breast cancer”为题发表在Biomaterials。

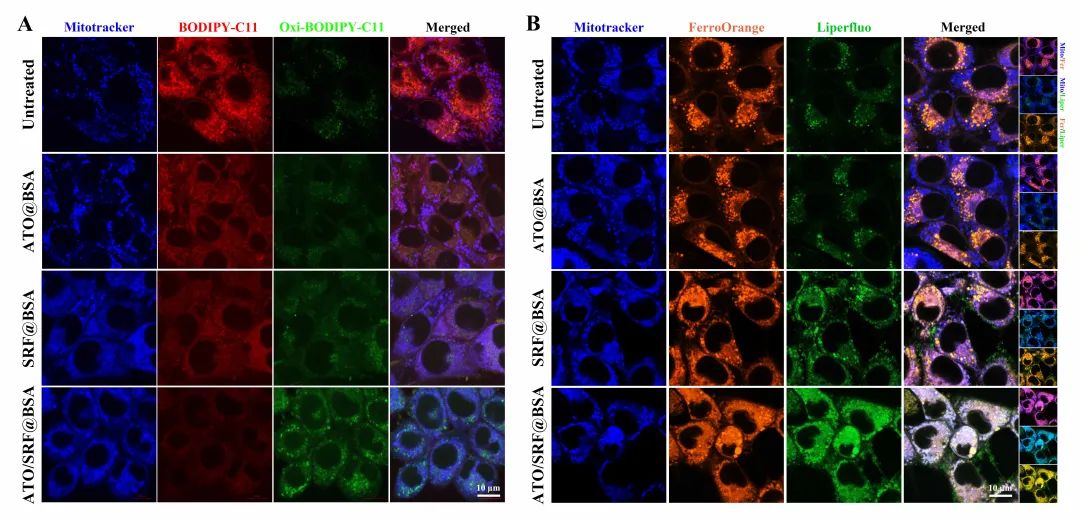
在这项研究中,白蛋白纳米药物可通过GSH-GPX4和DHODH-CoQH2双重抑制抑制驱动铁死亡的进程,在三阴性细胞系中展现出优异的杀伤效力。作者进一步证明经白蛋白纳米药物处理后,4T1细胞中不饱和脂质减少,脂质过氧化物堆积。使用 FerroOrange特异性标记胞内 Fe2+,证明4T1细胞中线粒体双层中分布着大量的不饱和脂质,并且不稳定的铁池受到严格调节,同时线粒体中的DHODH抵抗途径可有效清除脂质过氧化物。但该白蛋白纳米药物处理后,可增加不稳定铁池中Fe2+的含量,促进Fe2+在线粒体中的分布。并且白蛋白纳米药物中的阿托伐醌可有效靶向线粒体并抑制DHODH的活性,从而导致脂质过氧化物的大量产生。
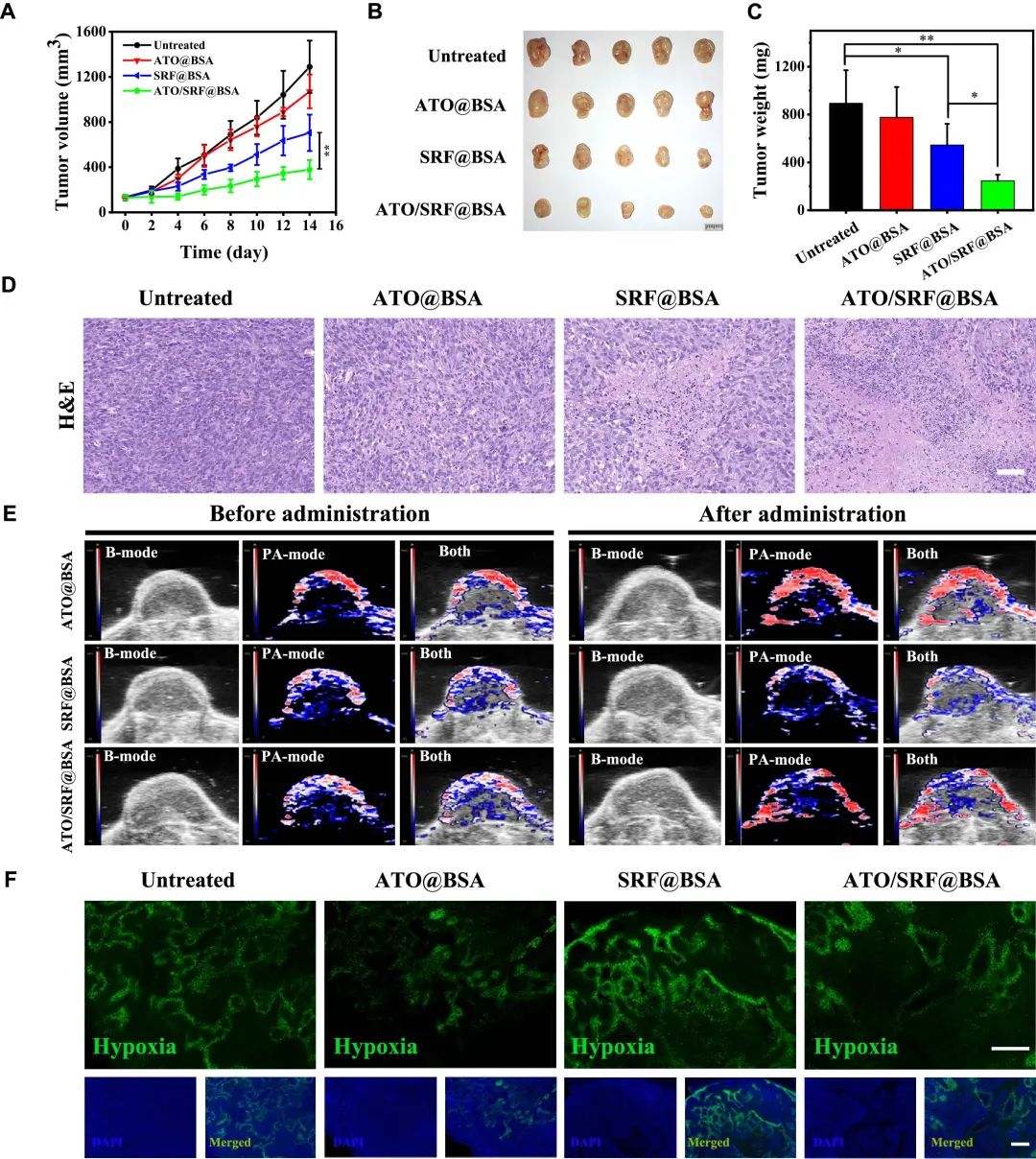
该白蛋白纳米药物能够显著抑制4T1肿瘤增殖并延长TNBC荷瘤小鼠的生存时间,表现出优异的抗癌效果,经白蛋白纳米药物处理的小鼠肿瘤组织中细胞密度显著降低,坏死区域的百分比大幅增加。同时该白蛋白纳米药物有效改善肿瘤组织中缺氧的面积和缺氧程度。这些作用效果赋予该白蛋白纳米药物作为铁死亡诱导剂在TNBC治疗应用中的巨大潜力。
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S0142961223004556
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#三阴性乳腺癌# #DHODH#
39