苏大杨凯/安医大裴佩/安工程陶玉贵合作《AM》:纳米酶涂层的细菌搭乘CD11b+免疫细胞调控肿瘤微环境增强放射免疫治疗
2023-12-17 BioMed科技 BioMed科技 发表于上海
基于细菌的药物递送策略由于其可基因工程、物理化学修饰与免疫激活特性等,近年来在肿瘤治疗方面受到了广泛的关注。
苏州大学杨凯教授、安徽医科大学裴佩副教授、安徽工程大学陶玉贵教授合作,在利用X射线协助CD11b+免疫细胞递送纳米酶涂层的细菌调控肿瘤微环境以增强肿瘤免疫治疗上取得了突破性研究进展,相关成果以“Nanozyme-coated bacteria hitchhike on CD11b+ immune cells to boost tumor radio-immunotherapy”为题发表在《Advanced Materials》上。
基于细菌的药物递送策略由于其可基因工程、物理化学修饰与免疫激活特性等,近年来在肿瘤治疗方面受到了广泛的关注。
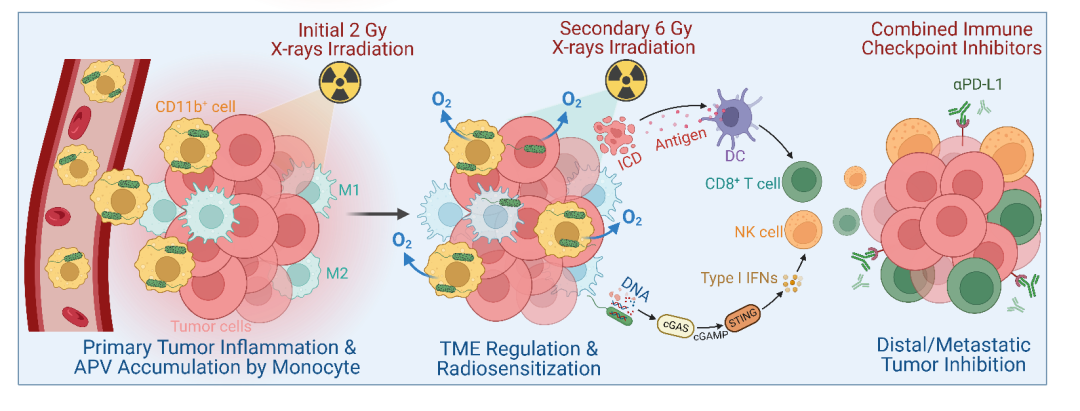
在前期的实验中,团队人员偶然发现尾静脉注射的微米级的灭活VNP20009细菌载体也可以在肿瘤部位富集,通过流式细胞术分析发现灭活VNP20009细菌进入体内后主要被CD11b+免疫细胞内吞,并上调血液中CD11b+免疫细胞的比例。因此,团队人员推测在肿瘤富集的VNP20009细菌可能主要是通过CD11b+免疫细胞的趋炎作用从而搭乘便车至肿瘤部位。基于上述观点,团队人员随后设计并通过一部还原法制备了双金属纳米酶涂层的VNP20009细菌载体(Au-Pt@ VNP20009,APV),在体外验证了APV的特性(高CAT活性、放疗增敏效应与激活cGAS-STING通路)。在体内,利用2 Gy X射线预照射引起更强的肿瘤炎症,进一步协助增强趋炎类免疫细胞对APV的递送效率。通过流式细胞术和IVIS荧光成像验证了X射线协助APV搭乘CD11b+免疫细胞的便车增强肿瘤靶向递送策略的可行性。当APV被协助递送至肿瘤后,可以有效解除肿瘤缺氧微环境并促进巨噬细胞M1极化和DC细胞成熟,从而提高放疗疗效与抗肿瘤免疫反应。最后,在联合6 Gy放疗和αPD-L1后可以促进CD8+ T细胞与NK细胞在肿瘤的浸润显著抑制肿瘤的生长和转移。总之,本研究成功利用X射线协助增强微米级纳米酶涂层细菌载体的肿瘤靶向递送并阐明了其中机理,为优化细菌基载体的递送策略开辟了新方法,同时为多功能细菌载体与肿瘤放射免疫治疗的有机结合提供了新思路。
该论文通讯作者为苏州大学放射医学与防护学院杨凯教授、安徽医科大学基础医学院裴佩副教授与安徽工程大学陶玉贵教授,共同第一作者为安徽工程大学硕士生李航航、安徽医科大学基础医学院裴佩副教授和安徽医科大学基础医学院本科生何青。
原文链接:
https://doi.org/10.1002/adma.202309332
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肿瘤微环境# #纳米酶涂层# #CD11b+免疫细胞# #放射免疫治疗#
53