药物滥用检测试剂注册审查指导原则(2023年修订版)
为加强医疗器械注册申报和技术审评指导,国家药监局器审中心组织制修定了《基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床试验注册审查指导原则》等3项注册审查指导原则,现予发布。
人类免疫缺陷病毒检测试剂临床试验注册审查指导原则(2023年修订版)
为加强医疗器械注册申报和技术审评指导,国家药监局器审中心组织制修定了《基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床试验注册审查指导原则》等3项注册审查指导原则,现予发布。
基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床试验注册审查指导原则
为加强医疗器械注册申报和技术审评指导,国家药监局器审中心组织制修定了《基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床试验注册审查指导原则》等3项注册审查指导原则,现予发布。
生物技术衍生的治疗用蛋白的免疫原性评价指导原则【英文版】
这份总结允许采用基于风险的方法来评价免疫原性,这意味着授予许可前的免疫原性研究和上市后风险管理计划的程度和类型可根据免疫原性风险及其潜在或实测后果的严重程度而调整。
FDA“药物、生物制品和器械去中心化临床试验供企业、研究者和其他利益相关者用的指导原则”介绍
去中心化临床试验(DCT)是指在传统临床试验场所以外的场所进行部分或全部与试验相关活动的临床试验。详细介绍FDA该指导原则草案,期待对中国开展DCT及其监管有所益处。
药物基因组学在药品的药物警戒中的应用的关键方面指南【中文版】
本指南回答药物基因组学对药物警戒活动的影响,包括考虑如何评估有药物基因组学关联的药品的药物警戒相关问题,以及如何将这些评估的结果转化为标签中的适当治疗建议。
药物基因组学在药品的药物警戒中的应用的关键方面指南【英文版】
本指南回答药物基因组学对药物警戒活动的影响,包括考虑如何评估有药物基因组学关联的药品的药物警戒相关问题,以及如何将这些评估的结果转化为标签中的适当治疗建议。
内镜切除术围术期抗血栓用药管理
药师应根据患者的不同用药情况,重点关注特殊人群,充分考虑凝血功能、肝肾功能、联合用药、血栓风险等情况,及时随访,与医师共同制定个体化治疗方案,使不良反应降至最低。
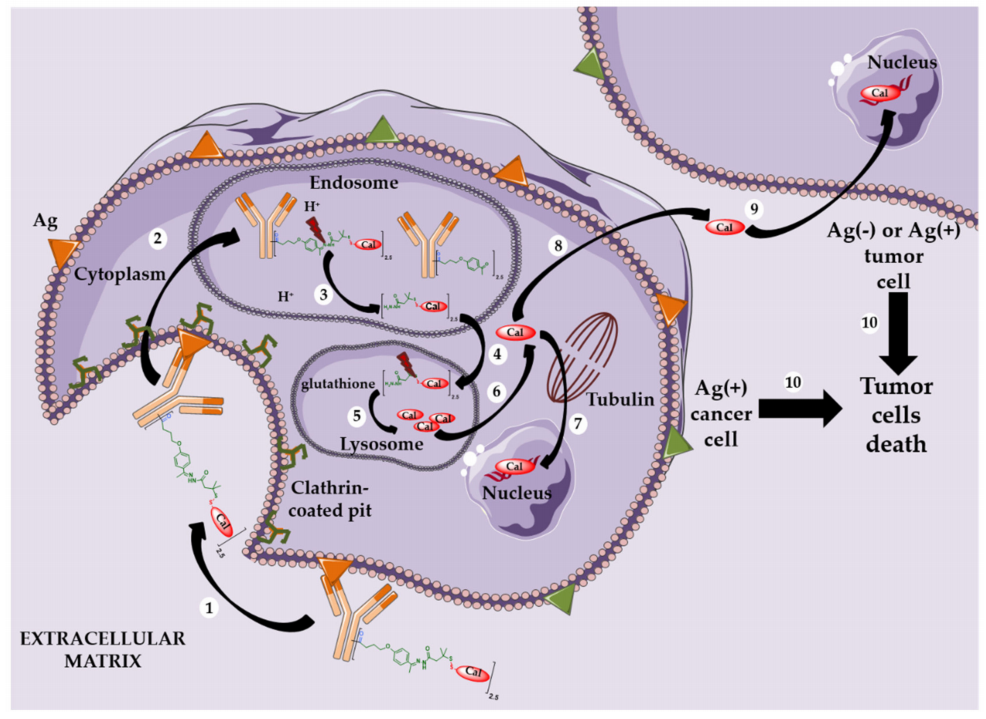
Nat Rev Clin Oncol:探索下一代抗体偶联药物(ADC)
ADC的治疗潜力巨大,但要实现这一潜力,需要克服几个关键挑战,如耐药性、肿瘤内和瘤瘤间异质性以及TRAE的风险。新兴的ADC模式,包括双特异性和双载荷ADC,显示出解决耐药性和肿瘤异质性的潜力
哮喘治疗药物的临床研究指南【中文版】
本文件是2003年5月生效的指导原则注释(CPMP/EWP/2922/01)的修订版。本文件应作为哮喘治疗药物开发的一般指导原则,并应与可能适用于该疾病领域和患者人群的其他欧洲和ICH指导原则一起解读