KRAS G12C抑制剂竞赛已打响,索托雷塞仍驻守 KRAS “神药” 之位
2022-12-01 找药宝典 找药宝典 发表于上海
KRAS是肿瘤的常见驱动基因,KRAS蛋白表面没有适于小分子抑制剂结合的口袋,目前全球范围内已有一款 KRAS 靶点药物获获批上市——索托雷塞(AMG510),终于打破了 KRAS不可成药靶点的神话。
KRAS是肿瘤的常见驱动基因,出现在近90%的胰腺癌,30-40%的结肠癌,和超过30%的肺腺癌中。然而,由于KRAS蛋白表面没有适于小分子抑制剂结合的口袋,导致靶向KRAS的小分子药物开发在接近40年里没有重大突破。幸运的是,目前全球范围内已有一款 KRAS 靶点药物获批上市——索托雷塞(AMG510),终于打破了 KRAS不可成药靶点的神话。
索托雷塞(AMG510)
驻守KRAS “神药”之位
索托雷塞(AMG510)是一款于2021年5月29日获得FDA加速批准上市用于治疗至少经过一次系统治疗的KRAS G12C突变的NSCLC患者,是全球首款针对KRAS的靶向药。
2022年8月31号,III期CodeBreaK 200临床研究达到了主要终点。在刚刚召开的ESMO大会上该试验报告了更为详细的研究结果。这项研究包含了345名携带KRAS G12C突变NSCLC患者,这些患者至少接受过一种含铂化疗和免疫检查点抑制剂的治疗,主要研究索托雷塞较之多西他赛在治疗KRAS G12C突变的NSCLC患者的疗效和安全性。其主要终点是无进展生存期(FPS),次要终点包括总生存期、客观缓解率以及患者报告结局。
该项试验初步分析显示在中位随访17.7个月时,索托雷塞组的PFS为5.6个月,较之多西他赛组为4.5个月有优势(HR=0.66;95% CI: 0.51-0.86;p=0.002)。索托雷塞组的1年PFS率为24.8%,多西他赛组为10.1%。

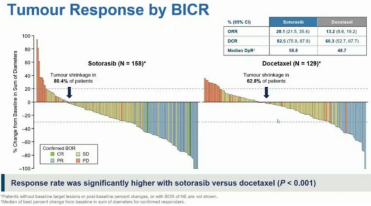
索托雷塞组的客观缓解率(ORR)(28.1%;95% CI: 21.5-35.4%)较之多西他赛组(13.2%;95% CI: 8.6-19.2%)更高,疾病控制率(DCR)分别为82.5%(95% CI: 75.9-87.8%)和60.3%(95% CI: 52.7-67.7%)。两组分别有80.4%和62.8%的患者肿瘤缩小。索托雷塞组的反应率显著高于多西他赛组(p<0.001)。
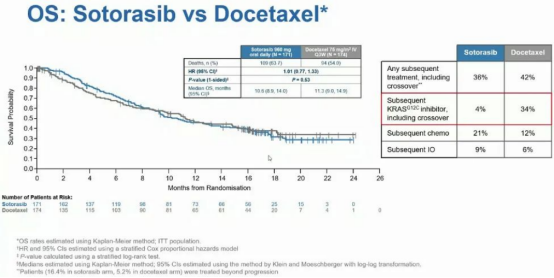
两组的总生存期(OS)并无显著差异(HR=1.01;p=0.53),索托雷塞组的中位OS为10.6(95% CI: 8.9-14.0)个月,多西他赛组的中位OS为11.2(95% CI: 9.0-14.9)个月。
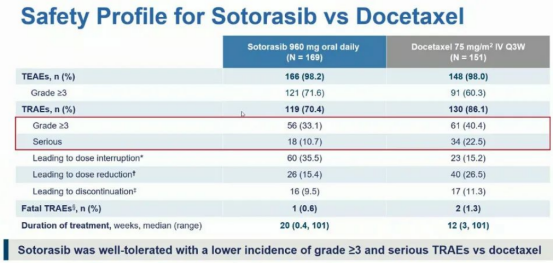
而索托雷塞组的药物安全性较好,3级及以上治疗相关的不良事件(TARE)发生率为33.1%,严重TARE发生率为10.7%,而多西他赛分别为40.4%和22.5%。
CodeBreaK 200临床试验的研究结果支持了索托雷塞成为KRASG12C突变NSCLC患者二线治疗的重要手段,尽管OS并无显著差异,但有明显的FPS收益和更好的安全性。
不用出境就可以和国外同步使用最新抗癌新药
海南博鳌乐城国际医疗旅游先行区是我国首个以国际医疗旅游服务为主要内容的国家级试验区,并且在肿瘤治疗领域形成产业集聚,特别是肿瘤新药发展加速推进,积极探路打造医疗健康开放新高地。目前多款肿瘤新药可惠及中国患者,文中提到的索托雷塞(sotorasib)已完美落地海南博鳌,并且根据进口药品带离管理暂行办法,患者经过审批,可将仅供自用的口服进口药品带离先行区,这也大大增加了患者用药的便捷性,降低了患者及家属用药衣食住行等辅助成本。
另,从目前国家政策来看,各渠道都在大力推广海南新特药的内地肿瘤患者用药,并且纳入多款城市惠民保免费用药政策,例如上海,北京,海南,内蒙和西宁,现在针对索托雷塞(AMG510)海南用药均可以报销。

KRAS G12C抑制剂激烈角逐
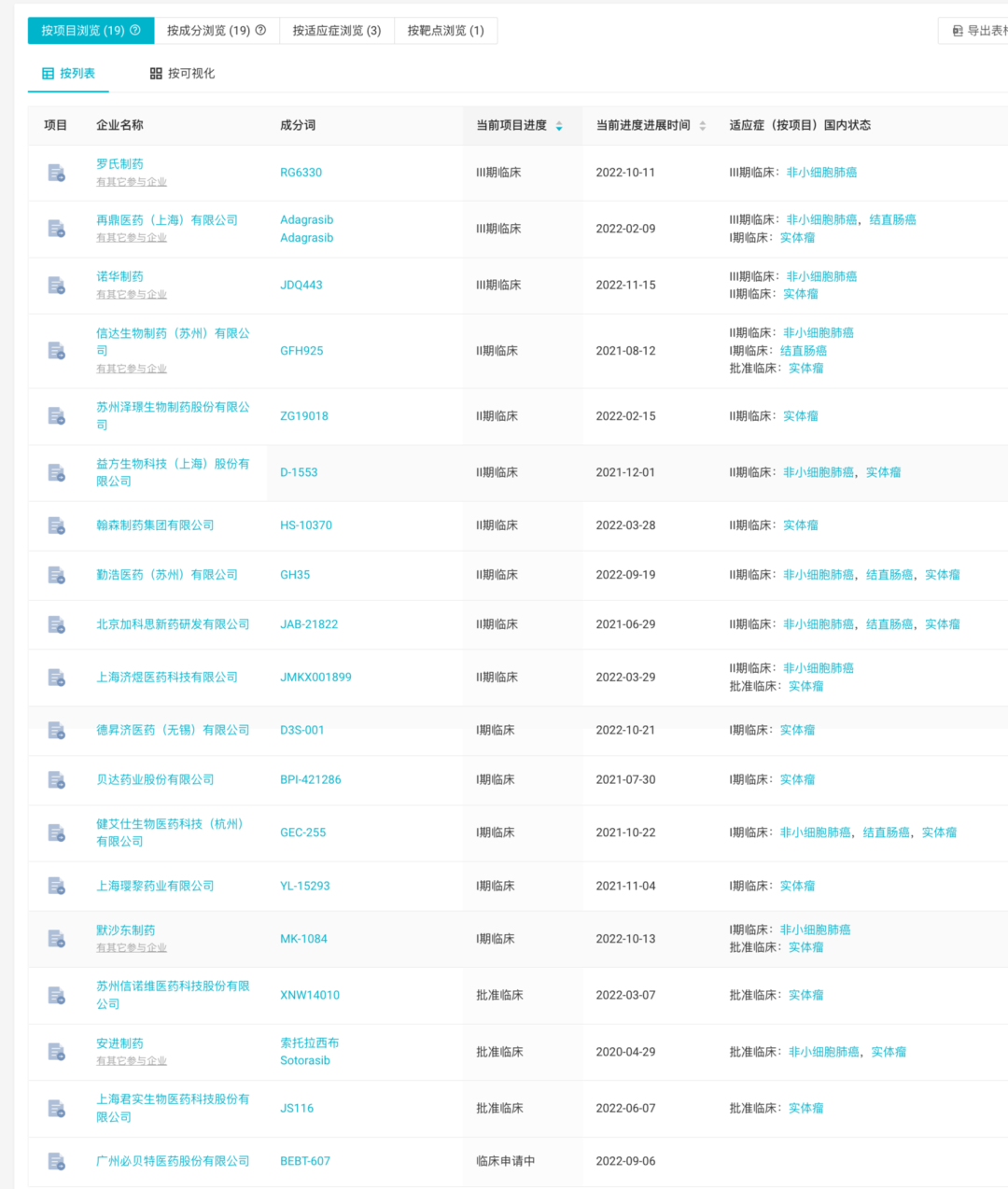
40年的时间里全球药企屡败屡战,秉承着不气馁的精神,当前已有多款KRAS G12C 抑制剂处于临床后期阶段,KRAS G12C领域的激烈竞赛已打响。
✦Mirati Therapeutics 的 Adagrasib(MRTX849)已向美国 FDA 递交新药上市申请
今年ASCO年会上公布了Adagrasib治疗经治KRAS G12C突变晚期NSCLC患者的KRYSTAL-1研究2期阶段结果。入组116例患者,患者接受Adagrasib 600 mg每天2次治疗,主要终点是BICR评估ORR。116例患者中,既往接受过1线、2线和3线以上患者比例分别是43%、35%和22%,98%的患者既往接受过含铂化疗和PD-1/PD-L1抑制剂治疗。
112例接受治疗的患者中,Adagrasib的ORR为43%,DCR 80%,中位DOR 8.5个月,中位PFS 6.5个月,中位OS 12.6个月,1年OS率51%。KRYSTAL-1研究中,Adagrasib最常见TEAR是腹泻,恶心,呕吐,乏力,转氨酶升高,肌酐升高,食欲不振等,其中3~4级TRAE发生率43%,2例TRAE导致死亡(分别是心力衰竭和肺出血)。导致减量的TRAE发生率为52%,导致剂量中断的TRAE发生率61%,导致治疗终止的TRAE发生率7%。
2 月 15 日,Mirati Therapeutics 宣布 FDA 已受理其 KRAS G12C 抑制剂 Adagrasib 用于治疗至少接受过一次全身治疗的 KRAS G12C 突变 NSCLC 患者的新药上市申请(NDA)。
✦诺华研发的 JDQ443 已处于 III 期临床
诺华公司在研的JDQ443正是一款KRAS G12C共价抑制剂。为了克服在其他 KRAS G12C 抑制剂中观察到的耐药性,JDQ443 设计了一种新的结合机制,在“switch II 口袋”下与KRAS形成新的相互作用,不可逆地将KRAS G12C 困在非活性的 GDP 结合状态。值得注意的是,JDQ443治疗晚期非小细胞肺癌患者的1/2期临床试验初步结果,
JDQ443 在 2022 年 AACR 年会上公布的 1b / 2 期 KontRASt-01 (NCT04699188) 试验的剂量递增部分的初始数据中显示了早期疗效信号和可耐受的安全性。在 NSCLC 患者亚组中,ORR 为 45%,7 名患者 (35%) 报告了确认的 PR。研究人员观察到 55% 的患者疾病稳定,没有疾病进展的报告,队列中有 2 名患者无法评估。接受推荐剂量的患者中确认的 ORR 为 57%。在安全性方面,接受推荐剂量的队列中,最常见的所有级别 TRAE 是呕吐 、水肿 和疲劳,没有报告 3 级 TRAE。
11月15日,中国药物临床试验登记与信息公示平台官网公示,诺华(Novartis)启动一项3期国际多中心(含中国)临床试验,以比较JDQ443与多西他赛治疗局部晚期或转移性KRAS G12C突变非小细胞肺癌(NSCLC)受试者的疗效和安全性。
✦ 益方生物的 D-1553 是国内首个自主研发并进入临床试验阶段的 KRAS G12C 抑制剂
D-1553是益方生物自主研发的针对 KRAS G12C突变的口服抑制剂,于6月获得国家药监局药品审评中心(CDE)突破性治疗药物的认定,这是中国针对 KRAS G12C 突变的自主创新药首次被纳入突破性治疗药物。
在2022美国癌症研究协会年会上,首次公布了其口服 KRAS G12C 抑制剂 D-1553 的临床数据。一项针对携带 KRAS G12C 突变的晚期或转移性实体瘤患者的I 期国际多中心试验中,D-1553 在 22 名患者中进行了评估,耐受性良好,没有任何剂量限制性毒性。在 21 名可评估患者中,确认的肿瘤客观缓解率 (ORR) 为19.0观察到 % 并实现了 85.7% 的疾病控制率 (DCR)。在低至每天 300 毫克的剂量水平下即可观察到肿瘤反应。
✦ 信达生物在 2022 CSCO年会上展示 IBI351 Ia 期研究临床数据
IBI351(GFH925) 是一种新型、不可逆的 KRAS G12C突变共价抑制剂。NCT05005234 研究旨在评估 IBI351 单药治疗对标准护理治疗失败或不耐受的晚期实体瘤患者的安全性、耐受性和有效性。在 55 名可评估的 NSCLC 患者中,28 名达到部分缓解 (PR),研究者评估的 ORR 为 50.9%,DCR 为 92.7%。在推荐剂量的NSCLC患者中,研究者评估的 ORR 为 61.9%(13/21) 和 DCR 为 100%。
全球还有更多KRAS G12C抑制剂进入临床阶段,至于谁能紧随其后打破KRAS靶点,还需更多临床试验结果进一步揭晓。
国内在研KRAS G12C抑制剂
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







