CCR:妇科癌症也需重视RAS突变,指导靶向治疗和评估预后
2024-05-19 苏州绘真医学 苏州绘真医学 发表于上海
本研究旨在描述妇科癌症中的RAS突变,因为它们与临床病理和基因组特征、生存和治疗的意义相关。

研究目的是描述妇科癌症中的RAS突变,因为它们与临床病理和基因组特征、生存和治疗意义相关。研究纳入了2010年2月至2022年8月期间在该中心具有可获得体细胞分子谱数据的妇科癌症,并根据RAS突变状态进行分组。生存分析采用Kaplan-Meier法,多因素分析采用Cox比例风险模型。
在3328例妇科癌症中,523例(15.7%)有RAS突变。RAS突变的患者更年轻(57岁vs 60岁未突变),有更高的子宫内膜异位症患病率(27.3% vs 16.9%),和更低级别(1/2级,43.2% vs 8.1%,均p<0.0001)。KRAS突变率最高的肿瘤为中肾样子宫内膜癌(100%,9/9)、中肾样卵巢癌(83.3%,5/6)、卵巢黏液癌(60.4%)和低级别卵巢浆液性癌(44.4%)。在校正年龄、癌症类型和分级后,RAS突变与较差的总生存率相关(HR=1.3,p=0.001)。特异性突变见于KRAS(13.5%)、NRAS(2.0%)和HRAS(0.51%),最常见的是KRAS G12D(28.4%)和G12V(26.1%)。常见的共突变为PIK3CA(30.9%)、PTEN(28.8%)、ARID1A(28.0%)和TP53(27.9%),其中64.7%为可干预的。对62例RAS突变的肿瘤患者给予RAS+MAPK靶向通路治疗。治疗组的总生存率显著较高(8.4年[95%CI 5.5-12.0] vs 5.5年[95%CI 4.6-6.6],HR=0.67,p=0.031),但在多变量分析中,这一效应并未持续。
妇科肿瘤的RAS突变具有独特的组织病理学分布,并可能影响总生存率。PIK3CA、PTEN和ARID1A是潜在可干预的共变异。应考虑靶向RAS通路治疗。
研究背景
RAS基因(KRAS、NRAS和HRAS)是最早被描述的癌基因之一,也是人类癌症中最常发生突变的基因家族。RAS家族的G蛋白是丝裂原活化蛋白激酶(MAPK)通路的主要调节者,由RAF-MEK-ERK信号轴定义,最终控制细胞周期进程、细胞存活、生长、代谢、运动和迁移。RAS突变会破坏鸟嘌呤交换循环,在GTP结合状态下持续激活它。RAS驱动的肿瘤发生是靶向治疗的一个明显靶点。
尽管经过几十年的发展努力,RAS仍未能成为治疗靶点,被称为“不可用药”。在非生物标志物选择的妇科癌症中,对RAS/MAPK通路进行下游抑制的各种策略也仅显示出一定的缓解(客观缓解率,ORR为6-16%;曲美替尼显著的ORR为26%)。然而,最近出现的等位基因特异性靶向RAS抑制剂是一个突破,重新点燃了人们的兴趣并加速了该领域的发展。在有特定KRAS密码子G12C突变的非小细胞肺癌中,索托雷塞(索托拉西布)和阿达格拉西布均显示出有意义的缓解(ORR分别为32.2%和42.9%),因此美国食品药品管理局加速批准了这两种药物。在正在进行中的KRYSTAL-1试验中,在妇科癌症队列中,阿达格拉西布单药治疗的ORR高达57.1%。RAF/MEK和FAK抑制剂[avutometinib+地法替尼(defactinib)]等新型下游联合疗法也显示出前景,尤其是在KRAS突变肿瘤中。其他值得关注的早期数据在较小的队列中报告。了解RAS突变谱对于确定RAS抑制剂治疗在妇科癌症中的适用性至关重要。
关于妇科癌症中RAS突变的历史报道主要是基于较小的病理学研究,包括发现RAS突变与子宫内膜样子宫内膜癌和黏液性卵巢癌相关的研究。最近,研究者对低级别浆液性卵巢癌和泛癌种进行了更大规模的基因组分析。在临床前模型中,尤其是在恶性转化中,KRAS突变与子宫内膜异位症相关,尽管在妇科癌症患者中的临床关联尚不清楚。此外,RAS基因突变在其他妇科肿瘤中的特征、与未突变的妇科肿瘤的比较、相关的治疗经验和生存结果也缺乏。因此,本研究旨在描述妇科癌症中的RAS突变,因为它们与临床病理和基因组特征、生存和治疗的意义相关。
研究结果
共计3328例妇科癌症患者接受了体细胞分子谱分析。除47例仅接受液体检测的患者外,所有患者均接受了基于肿瘤的检测。12例行RAS单基因检测。在这一总队列中,523例(15.7%)有RAS突变肿瘤,2805例(84.3%)有RAS未突变肿瘤(表1)。有体细胞RAS突变的患者在诊断时较年轻(57岁vs 60岁,p<0.0001),当前或既往诊断为子宫内膜异位症的比例较高(27.3% vs 16.9%,p<0.0001)。癌症类型和级别的分布在突变组之间是不同的,与RAS未突变组相比,RAS突变组显示出更高的子宫癌患病率(44.0% vs 32.4%,p<0.0001)和更低的级别(1或2级的频率,43.2% vs 8.1%;总体级别p<0.0001)。组间的第二原发癌病史相似(n=0.92)。全组患者的OS为5.3年(95%CI 5.0-5.7)。与RAS未突变的妇科恶性肿瘤患者的OS为5.2年(95%CI 4.9-5.6)相比,RAS突变的妇科恶性肿瘤患者的OS为5.8年(95%CI 4.9-6.9),在数字上超过但未显著较高(p=0.66)。
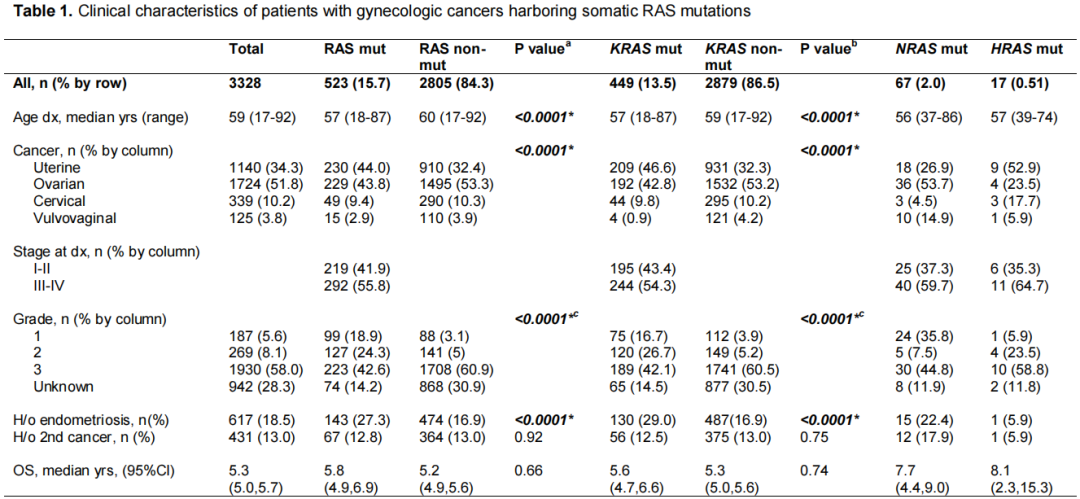
表1
具体的KRAS、NRAS和HRAS基因突变率分别为13.5%、2.0%和0.5%(占RAS的85.9%、12.8%和3.3%)。KRAS突变肿瘤患者与KRAS未突变肿瘤患者的比较显示出与RAS相似的趋势:诊断时年龄较年轻(57 vs 59),子宫内膜异位症的患病率较高(29.0% vs 16.9%),子宫癌的患病率较高(46.6% vs 32.3%),肿瘤分级较低(1级或2级的频率,43.4% vs 9.1%;所有p<0.0001)。KRAS突变组的OS为5.6年(95%CI 4.7-6.6),KRAS为突变组为5.3年(95%CI 5.0-5.6)(p=0.74)。NRAS或HRAS突变患者的临床特征也见表1。NRAS突变组的卵巢癌发生率高(53.7%),级别较低(1级或2级,43.3%),但分析受到样本量的限制。NRAS突变组和HRAS突变组的OS分别为7.7年(95%CI 4.4-9.0)和8.1年(95%CI 2.3-15.3)。
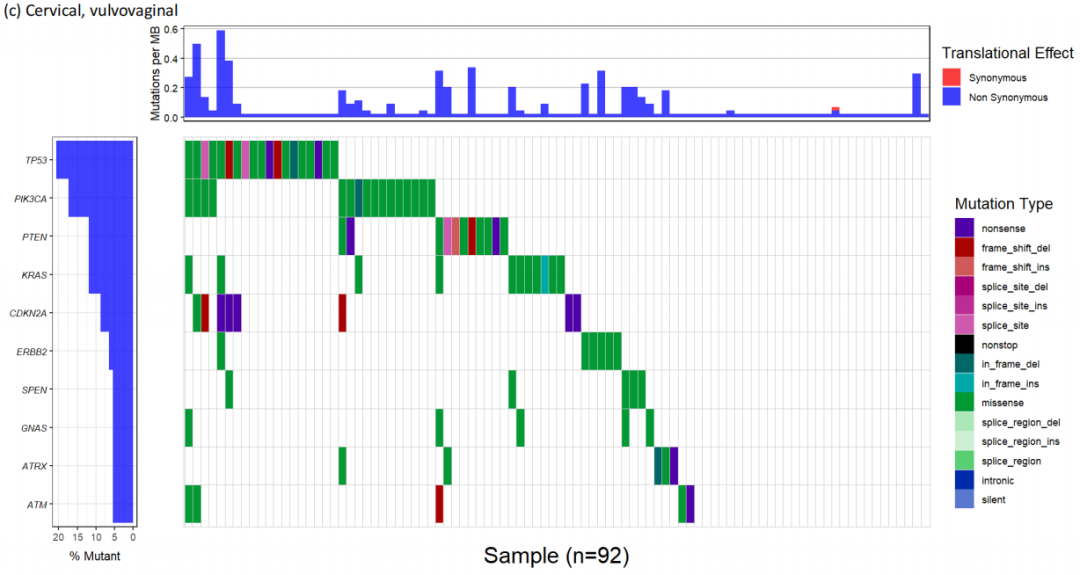
RAS突变妇科癌症患者的组织学分布见补充图1。在523例RAS突变癌症中,44.0%为子宫癌,43.8%为卵巢癌,9.4%为宫颈癌,3.9%为外阴阴道癌。其中,每种癌症最常见的组织学类型包括子宫内膜样子宫内膜癌(60.4%的子宫内膜癌,26.6%的RAS突变)、低级别浆液性卵巢癌(34.1%的卵巢癌,14.9%的RAS突变)、宫颈腺癌(59.2%的宫颈腺癌,5.5%的RAS突变)和外阴黑色素瘤(66.7%的外阴黑色素瘤,1.9%的RAS突变)。接下来,研究者缩合了整个队列的组织学分组,并根据RAS突变状态进行了比较(表2)。在每种癌症类型中,根据RAS和KRAS状态,组织学分布显著不同。与各自的未突变对照相比,RAS突变和KRAS突变的子宫内膜样子宫内膜癌(RAS,60.4% vs 30.7%;KRAS,62.2% vs 30.9%;p<0.0001)、低级别浆液性卵巢癌(RAS,34.1% vs 3.7%;KRAS,30.7% vs 4.8%;p<0.0001)和宫颈腺癌(RAS,59.2% vs 27.6%;KRAS:61.4% vs 27.8%;P<0.0001)的发生率更高。
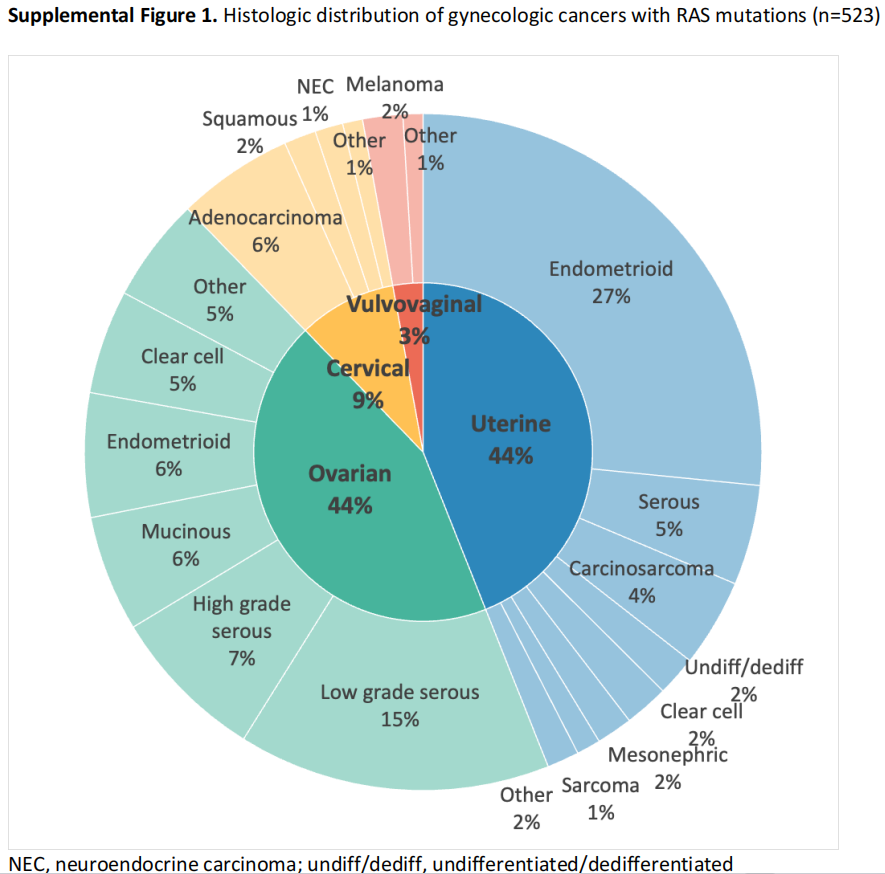
补充图1
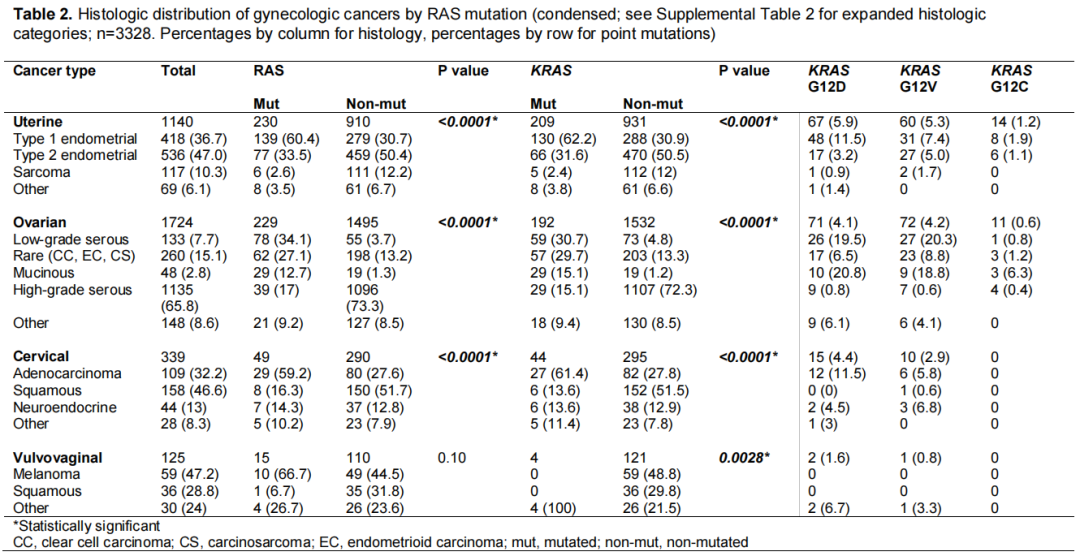
表2
此外,研究者检查了每种组织学类型中RAS突变的相对发生率(补充表2,图1中的KRAS)。虽然只有9例患者患中肾样子宫内膜癌,但100%的肿瘤均有KRAS突变。同样,中肾样卵巢癌中KRAS突变率为83.3%(n=6),中肾样宫颈癌中KRAS突变率为50.0%(n=2)。1例阴道癌组织学表现为中肾,未见KRAS突变。常见KRAS突变的其他组织学类型包括卵巢黏液癌(60.4%)、低级别卵巢浆液性癌(44.4%)、卵巢子宫内膜样癌(38.9%)、子宫内膜样子宫内膜癌(31.1%)、宫颈腺鳞癌(30.8%)和宫颈腺癌(不包括中肾组织学,24.8%)。NRAS和HRAS突变罕见(补充图2)。
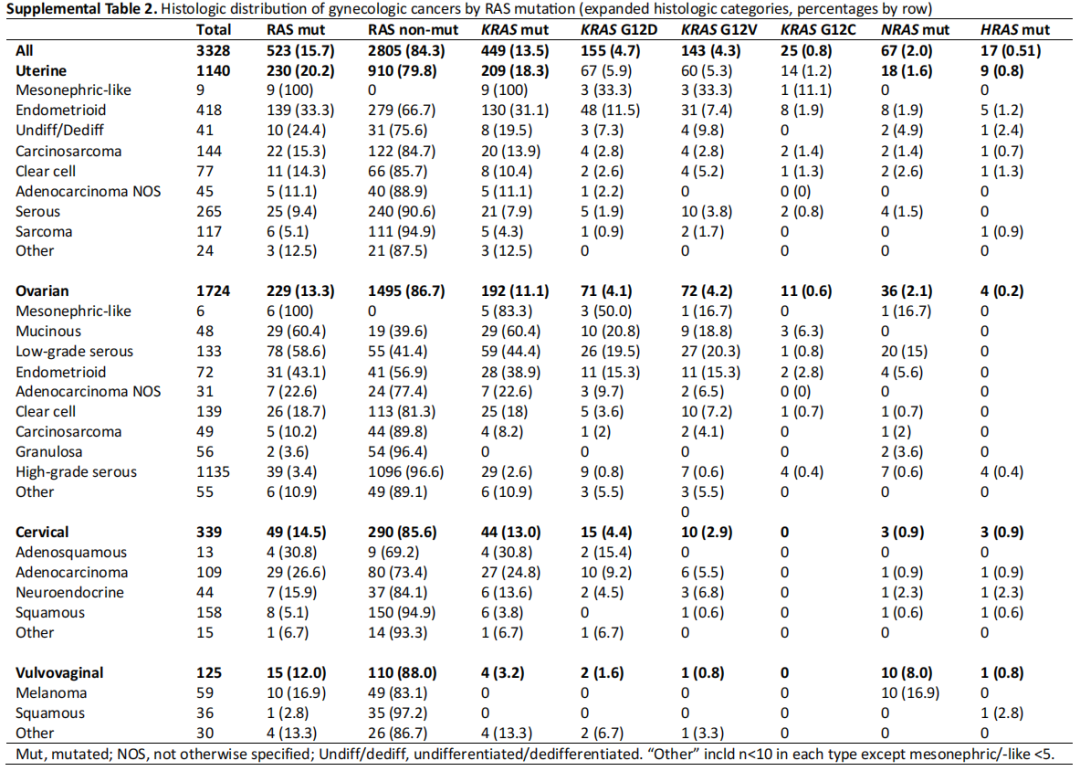
补充表2
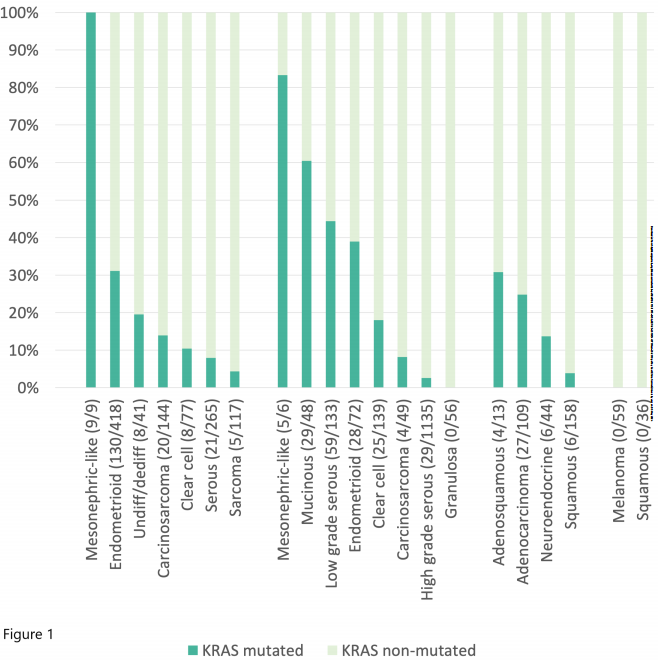
图1
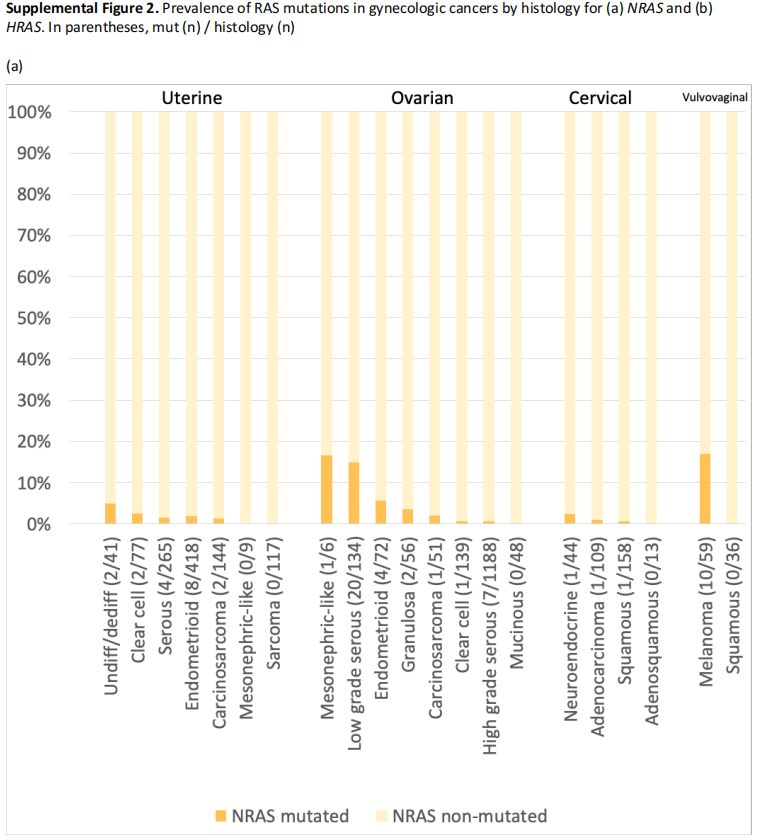
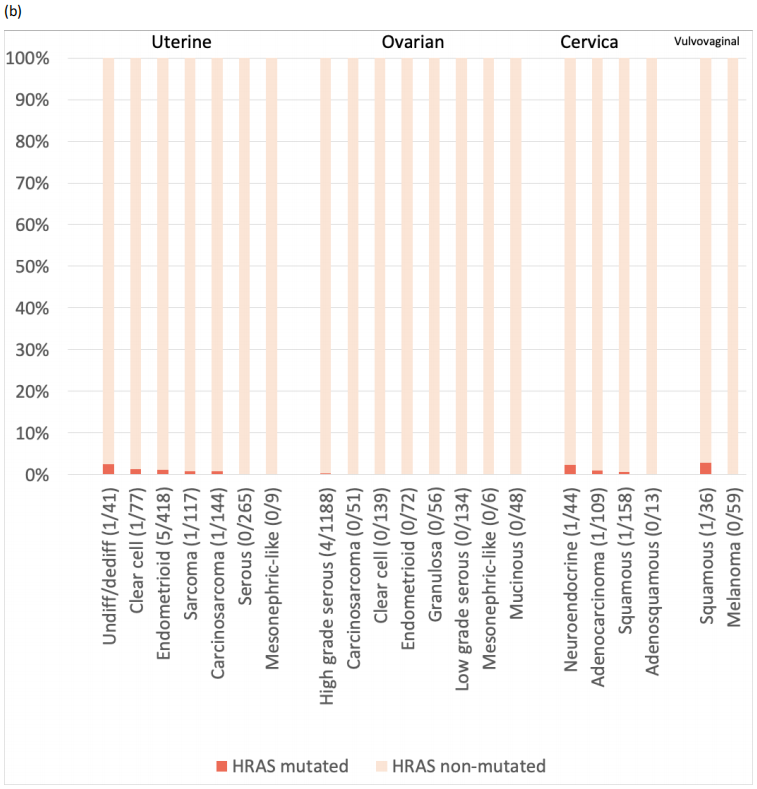
补充图2
与妇科癌症患者OS相关的因素是诊断时的年龄、肿瘤类型和分级。在控制这些因素的多变量分析中,体细胞RAS突变与较差的OS显著相关,风险比(HR)为1.3(95%CI 1.1-1.5,p=0.001;表3)。考虑到低级别浆液性卵巢癌的高患病率和已知的结局改善,研究者在排除这部分患者后重复了分析。在该分析中,RAS突变状态再次与较差的OS显著相关,HR为1.4(95%CI 1.1-1.6,p=0.0003)。
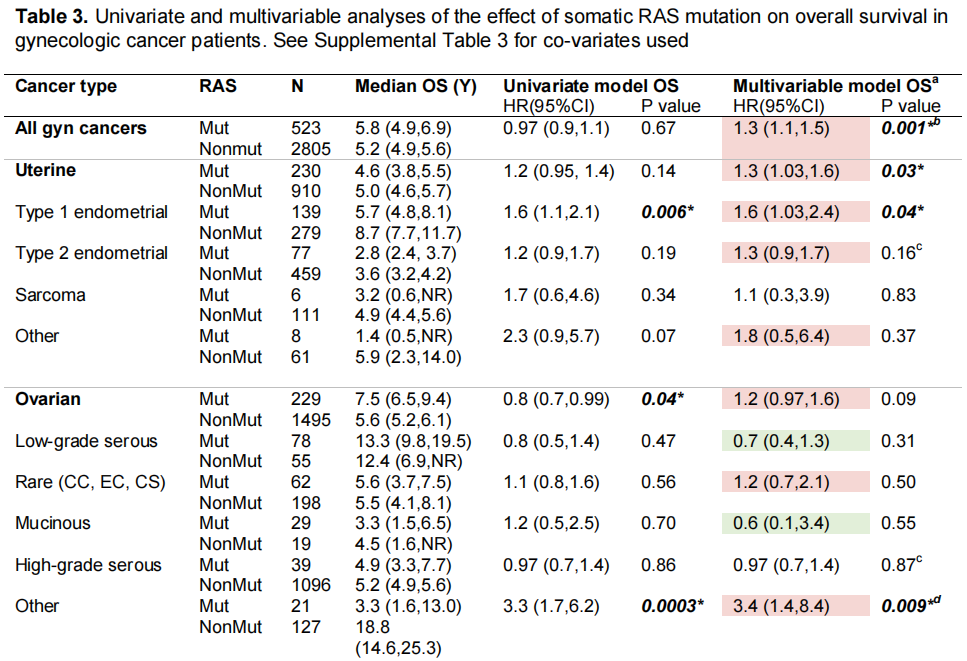
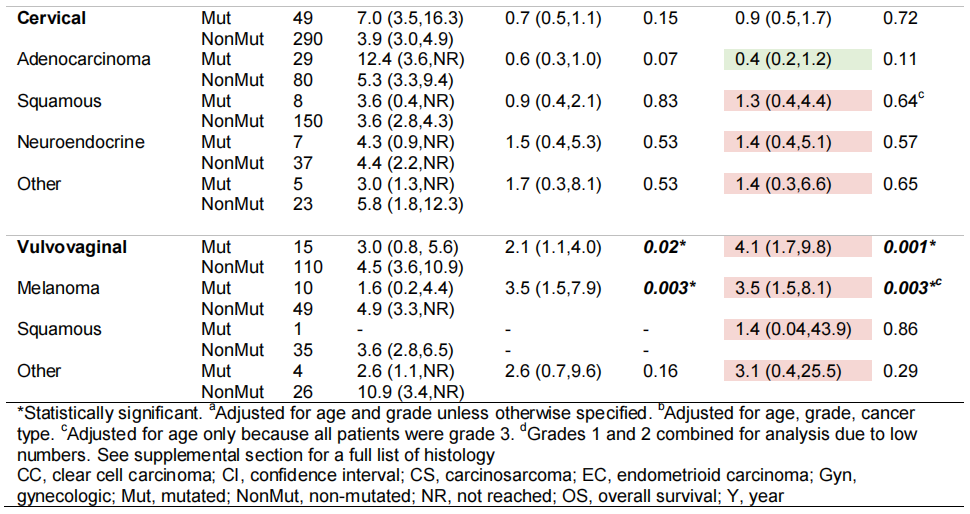
表3
对每种癌症类型和组织学重复进行探索性多变量生存分析,以评估效果;RAS突变肿瘤的样本量减少限制了可靠的分析(表3)。校正年龄和分级后,子宫癌(中位OS 4.6年vs 5.0年,HR 1.3 [95%CI 1.03-1.6],p=0.03)和外阴阴道癌(中位OS 3.0年vs 4.5年,HR 4.1 [95%CI 1.7-9.8],p=0.001)的OS显著较差。虽然RAS突变卵巢癌的中位OS有改善(中位OS 7.5年vs 5.6年),但年龄和分级的多变量调整导致了更差的HR 1.2(95%CI 0.97-1.6),尽管没有统计学意义(p=0.09)。总体而言,大多数组织学类型显示数字上较差的OS,统计学意义见于子宫内膜样子宫内膜癌(中位OS 5.7年vs 8.7年,HR 1.6 [95%CI 1.03-2.4], p=0.04),其他卵巢癌(中位OS 3.3年vs 18.8年,HR 3.4 [95%CI 1.4-8.4],p=0.009;包括颗粒细胞、中肾样、浆黏液性、腺鳞状、睾丸间质支持、卵巢甲状腺肿、间变性和非特指型腺癌),以及外阴阴道黑色素瘤(中位OS 1.6年 vs 4.9年,HR 3.5 [95%CI 1.5-8.1],p=0.003)。低度恶性浆液性、黏液性卵巢和宫颈腺癌的OS在数值上有所改善,但均无统计学显著性。
接下来,研究者对妇科癌症的RAS突变进行了基因组分析。最常见的突变是KRAS G12D(占RAS的28.4%,占总队列的4.7%)和KRAS G12V(占RAS的26.1%,占总队列的4.3%)。值得关注的是,KRAS G12C突变见于5%的RAS突变肿瘤(占总队列的0.8%)。这些关注的点突变的组织学分解见表2和补充表2。基于癌症类型,KRAS G12D突变的发生率分别为子宫癌5.9%、卵巢癌4.1%、宫颈癌4.4%和外阴阴道癌1.6%。KRAS G12D突变频率最高的组织学类型为中肾样卵巢(50.0%,n=3/6)、中肾样子宫内膜(33.3%,n=3/9)、黏液样卵巢(20.8%)、低级别浆液性卵巢(19.5%)、子宫内膜样卵巢(15.3%)和宫颈腺鳞癌(15.4%)。在子宫内膜癌、卵巢癌、宫颈癌和外阴阴道癌中,KRAS G12V突变的发生率分别为5.3%、4.2%、2.9%和0.8%。KRAS G12V突变率最高的组织学类型为中肾样子宫内膜(33.3%,n=3/9)、低级别浆液性卵巢(20.3%)、黏液性卵巢(18.8%)、中肾样卵巢(16.7%,n=1/6)和子宫内膜样卵巢(15.3%)。KRAS G12C突变发生率最高的组织学类型为中肾样子宫内膜(11.1%,n=1/9)和黏液性卵巢(6.3%)。在NRAS和HRAS中,Q61R和G12S分别是最常见的突变类型。
研究者还对RAS突变的妇科癌症进行了共突变分析。结果显示,PIK3CA(30.9%)、PTEN(28.8%)、ARID1A(28.0%)和TP53(27.9%)是最常见的共突变(表4)。当根据子宫癌、卵巢癌以及宫颈癌和外阴阴道癌的癌症类型分析共突变时,这一趋势也存在(补充图5)。在PIK3CA中大多数突变是激活的,在PTEN、ARID1A和TP53中大多数突变是失活的。这些变异中有64.7%被认为具有临床指导意义,包括91.1%的PIK3CA突变、83.7%的PTEN突变和50.0%的ARID1A突变。在这一队列中,TP53被认为不具有治疗意义。
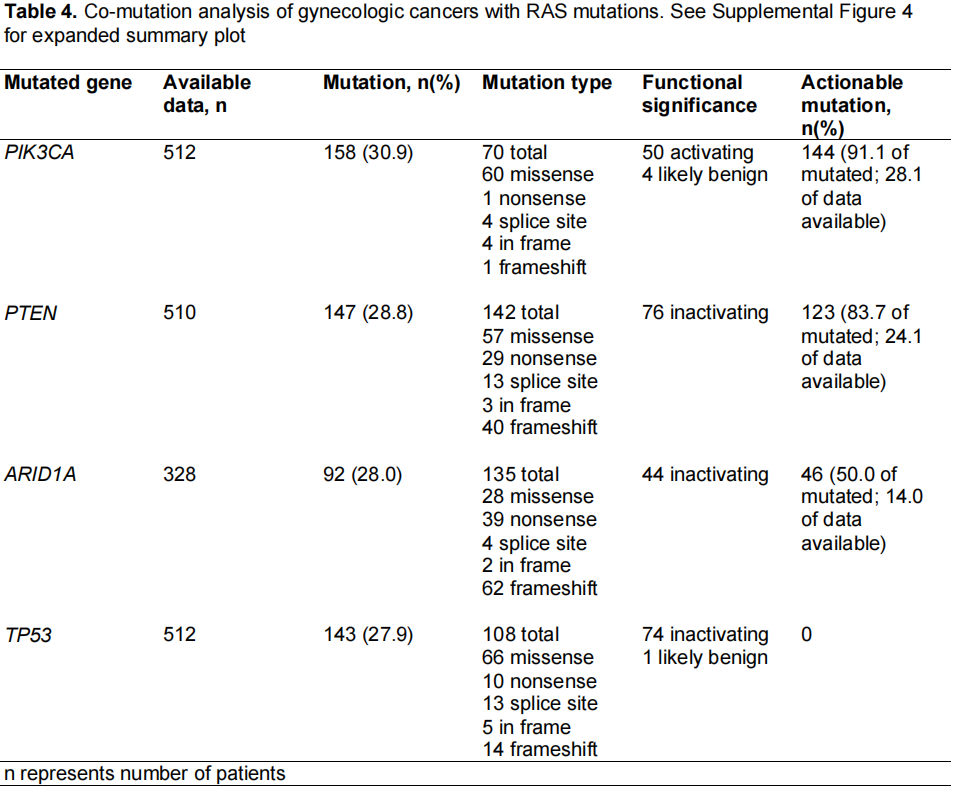
表4
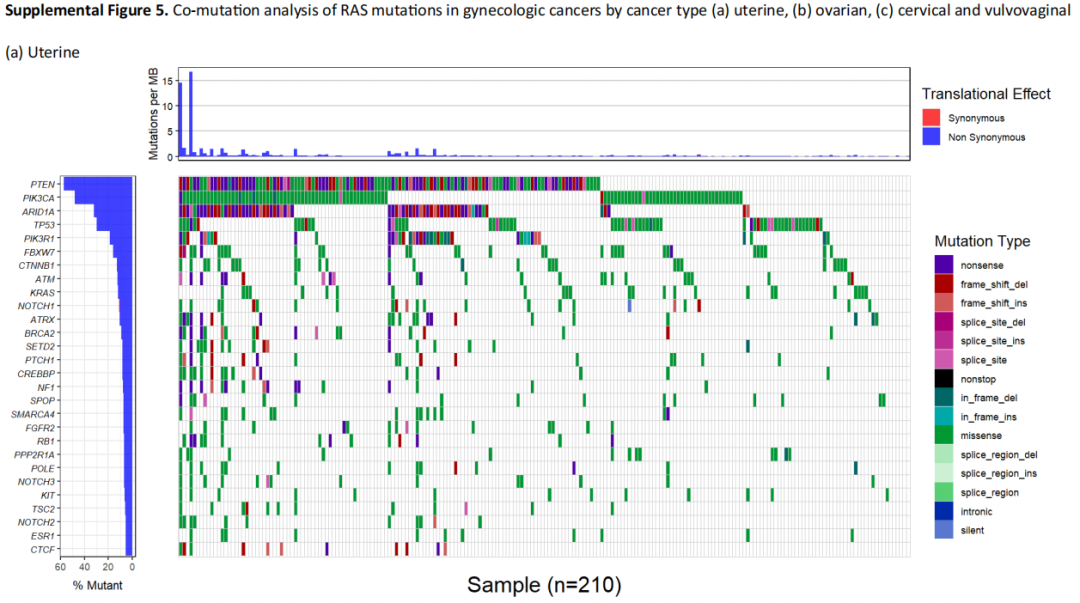
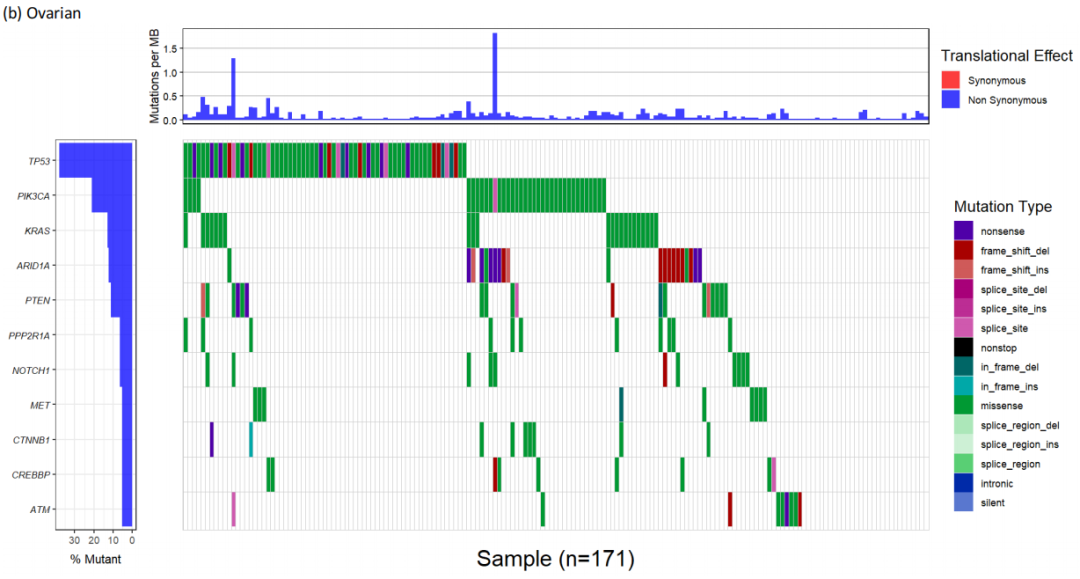
补充图5
RAS信号通路和MAPK通路抑制剂(以下简称“RAS+MAPK通路抑制剂”)包括靶向RAS、SHP2、SOS1、BRAF或MEK的药物。最后,研究者评估了RAS+MAPK通路抑制剂在RAS生物标志物选择的妇科肿瘤中的临床疗效。523例患者中有62例接受了靶向KRAS G12C、SHP2、BRAF或MEK的RAS+MAPK通路抑制剂治疗(表5a)。所有患者均未接受SOS1抑制剂治疗。其中包括42例卵巢癌(28例为低级别浆液性,14例为其他组织学类型)、17例子宫癌(9例为子宫内膜样,8例为其他组织学类型)、2例宫颈腺癌和1例阴道黑色素瘤。与未接受RAS+MAPK通路抑制剂治疗的RAS突变妇科癌症患者相比(5.5年,95%CI 4.4-6.6,HR 0.67,p=0.031),接受RAS+MAPK通路抑制剂治疗的患者显示出显著改善的OS(8.4年,95%CI 5.5-12.9)。然而,分别对卵巢癌和子宫癌队列的诊断年龄、组织学和分期进行校正后,RAS+MAPK通路抑制剂的使用与OS无关(两种癌症类型的p>0.05,表5b)。
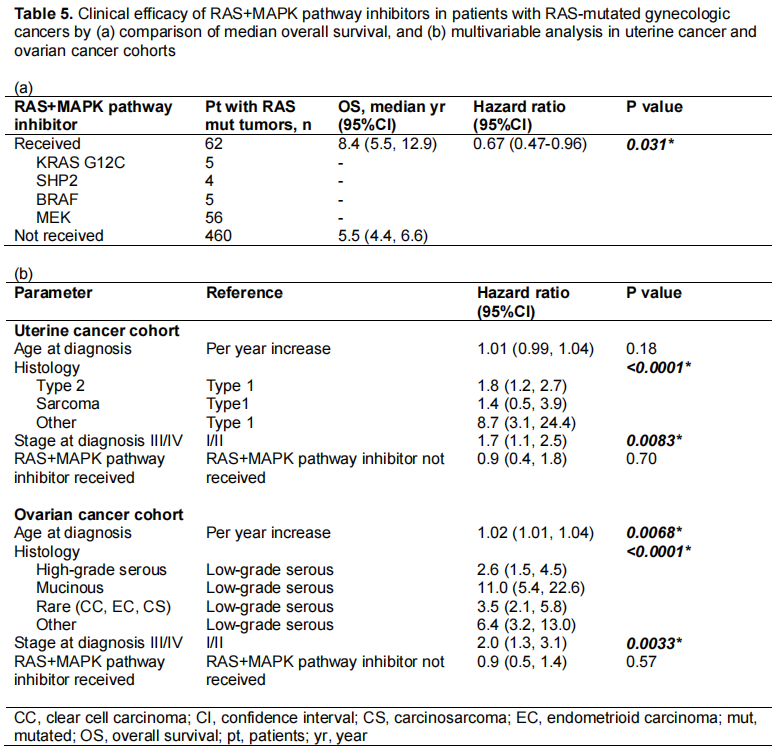
表5
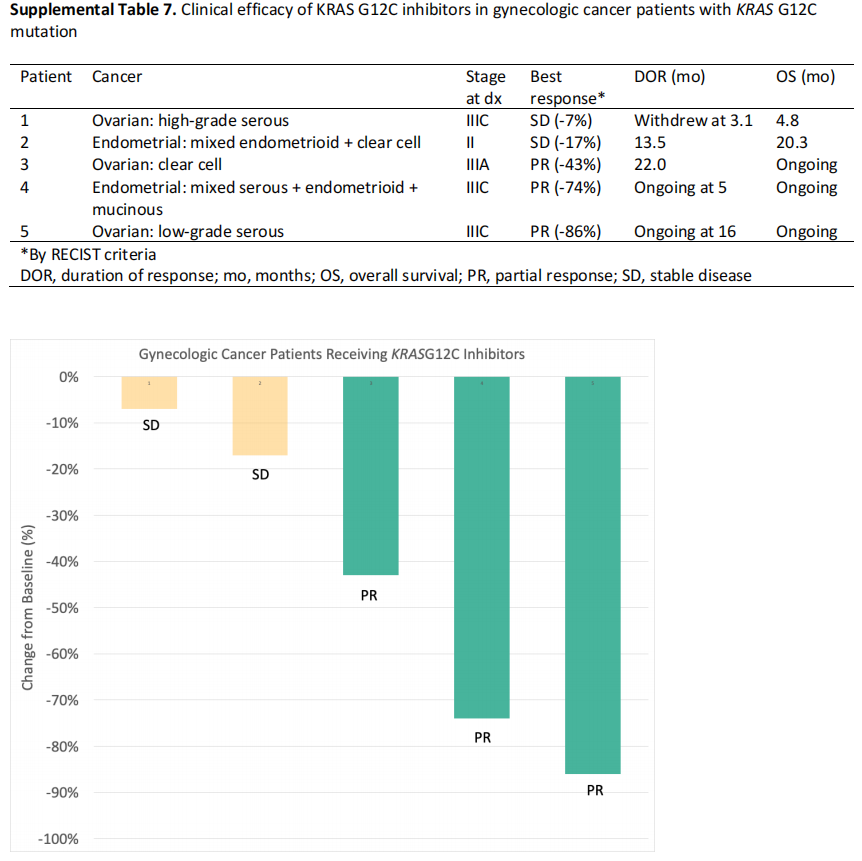
在肿瘤显示KRAS G12C突变的25例符合纳入条件的患者中,5例接受了KRAS G12C抑制剂治疗:3例患卵巢癌(高级别浆液性癌、低级别浆液性癌、透明细胞癌),2例患子宫内膜癌((混合性子宫内膜样,透明细胞;混合性子宫内膜样、浆液性、黏液性)(补充表7)。最佳疗效为3例部分缓解(根据RECIST标准分别为-43%、-74%和-86%),2例疾病稳定(分别为-7%和- 17%);部分缓解包括22.0个月的持续缓解,以及5个月和16个月时的持续缓解。所有患者均有临床获益。
补充表7
讨 论
携带RAS突变的妇科癌症具有独特的组织病理学分布,包括在中肾样癌、黏液性卵巢癌、低级别浆液性卵巢癌、子宫内膜样卵巢癌和宫颈腺癌中的高患病率。尽管RAS突变妇科癌症患者的特征包括诊断时年龄较小、子宫癌类型、级别较低和子宫内膜异位症,但在校正混杂因素后,RAS突变妇科癌症患者的生存期可能比RAS未突变癌症患者差。最常见的可干预共变异是PIK3CA、PTEN和ARID1A,这可能有助于联合治疗的设计。在试验背景下,应考虑对携带RAS突变的患者进行靶向RAS通路治疗。
在之前利用免疫组织化学或聚合酶链反应(PCR)方法进行的系列研究中,KRAS与低级别卵巢浆液性癌、卵巢黏液性癌和子宫内膜样子宫内膜癌相关。据报道,在子宫内膜癌中,KRAS突变的发生率约为18%-26%,这与癌症基因组图谱分析显示的25%和我们的数据一致。考虑到这些研究中检测的时间不同,发生率的相似性支持这种突变在致癌过程中较早发生。本研究的一个临床新组织学发现是RAS突变在中肾样癌、子宫内膜样卵巢癌和宫颈腺癌中的高频率。这与最近使用美国癌症研究学会肿瘤基因组学证据信息交换数据库对MAPK通路突变进行的一项研究有部分可比性。此外,研究者能够对接受体细胞分子谱分析的妇科癌症患者的单一机构队列中RAS突变的临床和生存特征进行统计分析。集中的专科病理学审核是本研究的优势。鉴别罕见但具有侵袭性的组织学类型(如中肾样癌)可能对未来的治疗有指导意义。
重要的是,大多数历史研究报告了RAS突变在妇科癌症(包括子宫内膜癌)中与预后无关,而其他研究报告了在亚组中与生存相关。在丹麦对卵巢癌队列进行的一项大型荟萃分析中,KRAS突变与较差的预后相关,这在之前的较小规模研究中未观察到。在宫颈癌队列中也有类似的发现。在本大数据集中,在控制了年龄、癌症类型和分级后,RAS突变与较差的总体生存率显著相关,在子宫内膜癌和外阴阴道癌中有独立意义,在卵巢癌中有趋势,在子宫内膜样子宫内膜和外阴阴道黑色素瘤组织学中有显著影响。近期对低级别浆液性卵巢癌开展的研究表明,在针对年龄、分期、既往交界性肿瘤的诊断、既往治疗、对铂类药物的敏感性以及使用全外显子组测序进行校正后,MAPK通路突变可改善OS。虽然这一组织学差异的原因尚不清楚,但在结直肠癌、肺癌、胰腺癌、甲状腺癌和血液系统癌症中,RAS突变与较差结局之间的关联已被证明。因此,本研究提示,在妇科癌症中,RAS突变的预后一般较差。
几种RAS下游抑制剂已在妇科癌症患者中进行了临床试验。总体而言,靶向RAF或MEK的RAS/MAPK通路单药治疗的缓解率为6%-16%,令人失望。这些研究中的一个重要考虑因素是生物标志物的选择。虽然司美替尼对所有复发或持续性子宫内膜癌患者的疗效不符合试验前的标准,但作者推测选择生物标志物有潜在益处。在低级别浆液性卵巢癌中,在KRAS突变或BRAF突变癌症患者的小队列中对司美替尼进行的探索性分析未显示出预测相关性,但是对比美替尼与研究者选择的化疗进行的事后比较分析再次将KRAS突变与改善的治疗反应联系起来。在最近一项比较曲美替尼与标准治疗用于低级别浆液性卵巢癌的2/3期试验中,曲美替尼组的中位无进展生存期显著改善,分别为13.0个月和7.2个月。每组的KRAS突变发生率均为11%-12%,KRAS、BRAF或NRAS突变与无进展生存期(13.2个月vs 7.3个月,HR 0.41)和客观缓解率(ORR,50.0% vs 8.3%,HR 15.1)显著增加相关。作者认为该突变谱可能是ORR的预测因素(p=0.11)。在本研究中,接受RAS+MAPK通路抑制剂治疗的RAS突变癌症患者与未接受RAS+MAPK通路抑制剂的该类患者相比,OS显著改善,分别为8.4年和5.5年(HR 0.67, p=0.031),尽管在多变量分析中差异无统计学意义。在小样本量的患者中纳入了以下游为主的异质性治疗方案,这限制了研究者的分析。结合RAS突变的不良预后意义和前瞻性试验的现有数据,研究者建议考虑在RAS突变的妇科癌症患者中进行RAS通路抑制剂试验。
由于RAS通路信号传导的复杂性,包括下游各种代偿机制,目前正积极探索RAS通路抑制剂的联合治疗。临床前研究表明,激活的PI3K通路对MEK抑制剂有反应,因此,RAS和PIK3CA通路的双重抑制在体内外均显示出协同作用。不幸的是,尝试这一联合疗法的研究报告了无法接受的毒性。在本研究数据中,无论癌症类型如何,PIK3CA和PTEN均经常发生变异。寻找新药和减少毒性的治疗方案仍然至关重要。ARID1A被发现是另外一个候选基因。此外,KRAS G12C抑制剂在妇科癌症患者中显示出可靠的疗效。因此,开发更多上游靶点的靶向抑制剂可能会带来有前景的结果。临床试验中的此类抑制剂包括KRAS-off、RASon、SHP2和SOS1抑制剂。
本研究有几个局限性。虽然本研究包括了迄今为止关于RAS突变妇科癌症的最全面的临床基因组学、生存期和治疗数据,但也受到了纳入异质性癌症类型、基因组平台和治疗方案的限制。针对其中一些因素进行了统计学校正。虽然这项研究的时间跨度为12年,但在此期间,在妇科癌症中获批的靶向生物标志物疗法并不会显著有利于针对特定疾病类型的panel-based体细胞分子谱分析。然而,由于体细胞分子谱分析通常是在复发患者中,因此这一选择标准可能使患者人群偏向于更高危的患者。事实上,研究者无法获得有关治疗线的数据,但假设是复发患者,这与从诊断到分子检测的中位时间为24个月一致。在这方面,测序时间本身可能存在左侧截断偏倚,但由于两个比较组均需要进行检测,因此这一偏倚有所减轻。同样,时间偏倚也是可能的。每种组织学的总生存分析本质上是探索性的,并受样本量的限制。正如在低级别浆液性卵巢癌中所证实的那样,研究者承认RAS可能根据组织学类型具有不同的预后。尽管在标准治疗和临床试验中均纳入了RAS+MAPK通路抑制剂,但接受治疗的患者数量不多,限制了可靠的统计学分析。此外,接受RAS+MAPK通路抑制剂治疗的患者仍然存在左侧截短生存偏倚,研究者试图在多变量分析中纠正这一偏倚。微小的局限性包括缺乏胚系检测结果,子宫内膜异位症病史可能存在报告偏倚,以及正在进行的试验中,在接受RAS+MAPK通路抑制剂的患者中,关于联合治疗的信息有限。非典型RAS突变可能在未来的研究中进行探索。尽管有这些局限性,但这项研究代表了一个大型的单机构数据集,包含了携带RAS突变的妇科癌症的详细临床和分子特征,包括对生存期和治疗方案的新见解。
在妇科癌症中RAS突变是一种相对普遍的、临床上独特的变异,对生存有潜在影响。开发工作的重点应是针对该人群的靶向RAS通路治疗,尤其是联合治疗。
参考文献:
Son J, Zhang Y, Lin H, et al. Clinical and genomic landscape of RAS mutations in gynecologic cancers. Clin Cancer Res. Published online April 30, 2024. doi:10.1158/1078-0432.CCR-23-2819

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#靶向治疗# #RAS突变# #妇科癌症#
0