协和医学杂志:全骨髓全淋巴链照射助力造血干细胞移植前清髓
2023-08-20 协和医学杂志 协和医学杂志 发表于加利福尼亚
TMLI预处理治疗是应用先进的放疗技术进行的全身清髓方式,可针对性照射总骨髓和淋巴,并可实现不同剂量梯度照射,同时减少对正常组织器官的照射剂量。
1 病例资料
患者女性,14岁,主诉“骨髓增生异常综合征伴髓系肉瘤,3疗程DCAG化疗后”,于2022年5月2日收住北京协和医院放射治疗科。
患者自2021年6月起出现左眼视力下降,按“眼部炎症”治疗后疗效不佳。
2021年9月29日就诊于北京儿童医院,行骨髓穿刺术未见明显异常。
2021年10月22日PET/CT结果示:左侧肾上腺区可疑软组织密度结节,18F-氟代脱氧葡萄糖(18F-FDG)代谢增高;骨质密度弥漫性不均匀伴多发低密度骨质破坏区、长骨髓腔密度不均匀增高,18F-FDG代谢弥漫性增高;肝大、脾大,18F-FDG 代谢增高;考虑肿瘤性/增生性疾病可能,血液系统疾病;左肾上腺区肿瘤性病变伴全身多发骨/骨髓转移,必要时行骨髓活检;左眼视网膜脱离伴网膜下积液、左眼眼球壁颞侧稍增厚,18F-FDG 代谢增高,左眼葡萄膜转移待除外。
2021年11月4日在局麻下行双侧骨髓活检术,术后骨髓形态学见原始细胞增多,流式细胞术提示为异常表达的髓系原始细胞,亲嗜性病毒整合位点1(EVI1)(+)。结合免疫组化及流式检测,考虑为髓细胞源性恶性肿瘤。综合考虑诊断为骨髓增生异常综合征伴髓系肉瘤。
自2021年11月18日起,采用DCAG(地西他滨+阿糖胞苷+阿柔比星+吉粒芬)方案进行化疗,现已完成3疗程治疗。
2022年4月18日行PET/CT治疗后好转,左侧肾上腺病灶存在轻度代谢可能。近1个月患者精神、饮食、睡眠尚可,二便如常,体质量无明显变化。
既往史:无特殊。
个人史及家族史:顺产出生,生长发育与同龄相仿。12岁初潮,月经周期及经量正常,无家族类似病史。
入院查体:血压 110/60 mm Hg (1 mm Hg=0.133 kPa),呼吸18次/min,脉搏86次/min,血氧饱和度99%,体质量指数(BMI)15.82 kg/m2。
一般状态良好,全身浅表淋巴结未触及明显肿大,心肺听诊无特殊,各瓣膜区未闻及明显杂音,腹软,未触及明显包块,无压痛、反跳痛,肝脾肋下未及,双下肢、双足无可凹性水肿。
2 全骨髓全淋巴链照射治疗
治疗前进行放疗定位及靶区勾画,设计应用螺旋断层治疗加速器(TOMO加速器)进行全骨髓全淋巴链照射(TMLI)预处理治疗的全流程(图1),共计1周,再进行放射治疗。
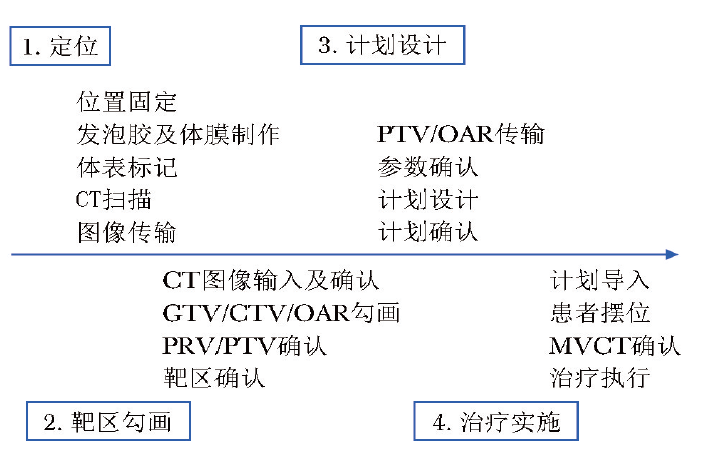
图1 应用TMLI治疗的全流程设计
TMLI:全骨髓全淋巴链照射;GTV:肿瘤体积;CTV:临床靶体积;OAR:危及器官;PRV:计划危及器官;PTV:计划靶体积;MVCT:兆伏级CT
2.1 放疗定位
扫描前分别在患者肚脐上5 cm,膝关节下5 cm处进行标记。采集正常呼吸时相的CT图像。采用头颈肩热塑膜进行固定,体部采用真空垫/发泡胶进行定位,手和手臂尽可能贴紧身体,扫描范围从头顶至脚趾末端。
由于患者身高>130 cm,需分两段进行CT扫描,第一段从头顶至大腿下部,头先进,扫描层厚5 mm;另一段从脚趾至大腿上部,脚先进,扫描层厚5 mm(图2),扫描时长共30 min。
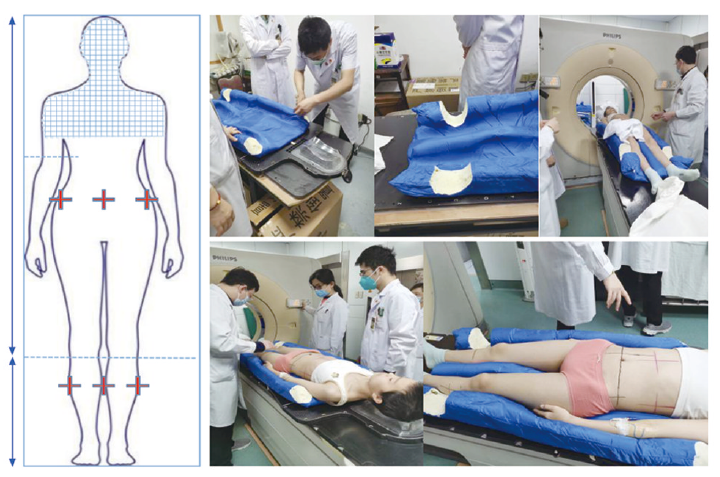
图2 患者放疗定位图
2.2 靶区勾画
TMLI的靶区定义为全骨髓、全淋巴系统、脾、肝脏与大脑和睾丸(本病例为女性,未包括);全骨髓包括头骨、肱骨、肩胛骨、锁骨、胸骨、椎骨、肋骨、髋骨、股骨、四肢骨等;危及器官包括晶体、眼球、腮腺、口腔、双肺、心脏、胃、肾脏。
由于患者眼球受累,多发骨髓受累,分为3个剂量梯度,PCTV1:12 Gy/10次(1.2 Gy/次),全中枢、全骨髓、全淋巴;CTV2:15 Gy/10次(1.5 Gy/次),受累的骨髓;CTV3:20 Gy/10次(2 Gy/次),眼球、乳房(图3),治疗时长共7 h。
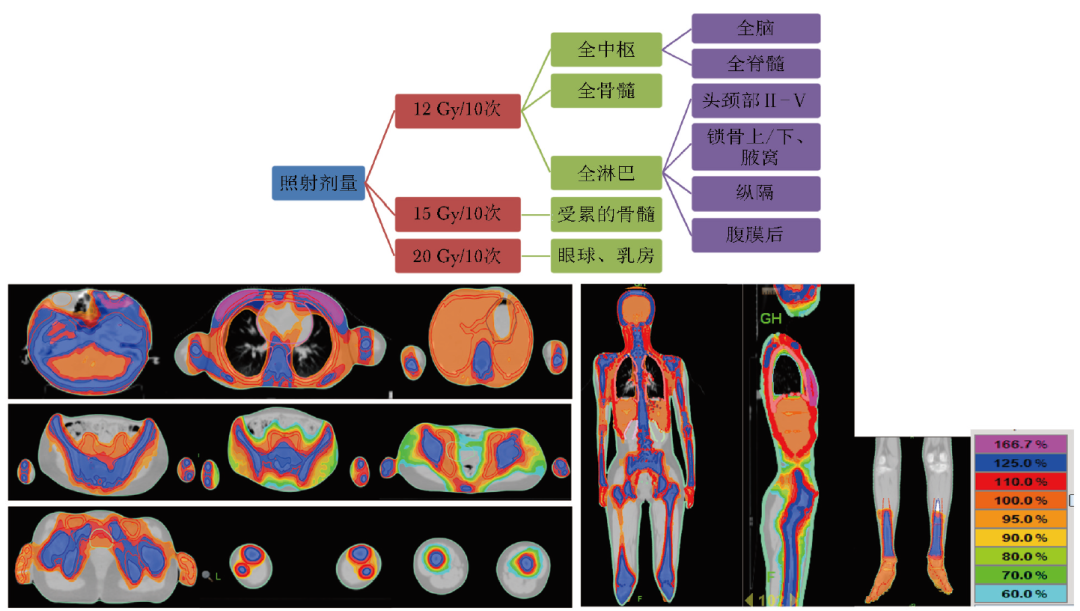
图3 放疗靶区剂量及范围
注:不同颜色表示不同剂量范围
2.3 计划设计
选择TOMO加速器(Tomo Therapy®System,Hi·Art)进行治疗计划设计,根据治疗处方(1.2 Gy/次)、患者身高(155 cm),左右PTV大小>17 cm和治疗效率等因素,分成上下两个靶区进行拆分优化,计划优化选择射野宽度5 cm,螺距为0.287,调制因子为2.6。
对比前期研究分野并采用前后平行相对(AP-PA anterior posterio)照射,TOMO的优势可采用剂量跌落区域进行优化,上下靶区通过治疗计划进行优化,剂量衔接区域的优化要求确保精确规定的剂量梯度,最终获得符合临床要求的靶区剂量分布(表1)。
表1 危及器官受量
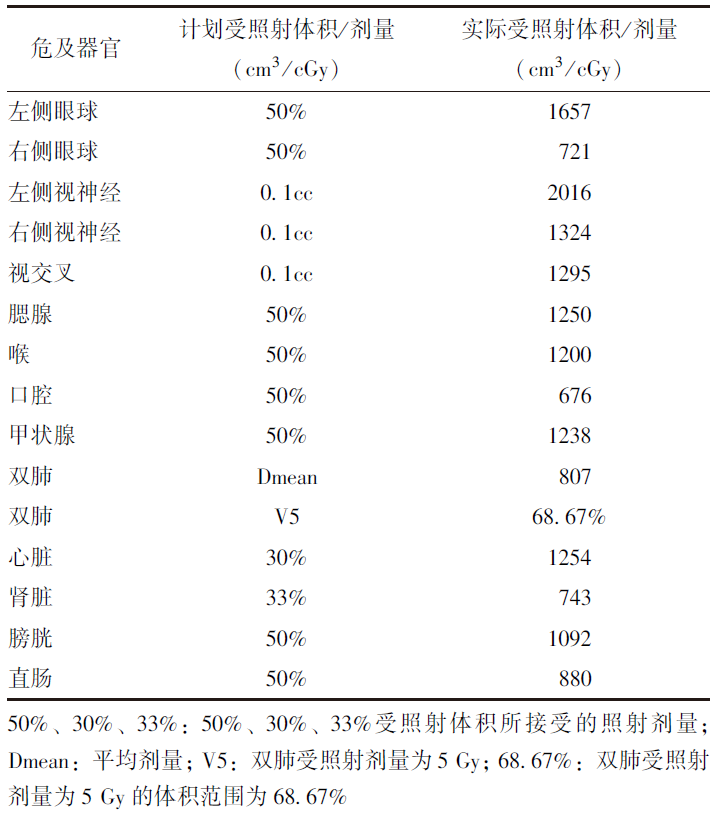
2.4 治疗过程
机房治疗时摆位需注意床头电气部分、四肢摆位及MVCT(腹部、衔接部位),治疗过程中首次治疗时进行了in vivo 胶片测量,注意观察患者状态。上段计划执行过程手动中断,完成一次治疗的时间为45 min~1 h。进行患者治疗前剂量验证(PSQA)及患者治疗位置的准确性(治疗前、中、后的MVCT)验证(图4)。
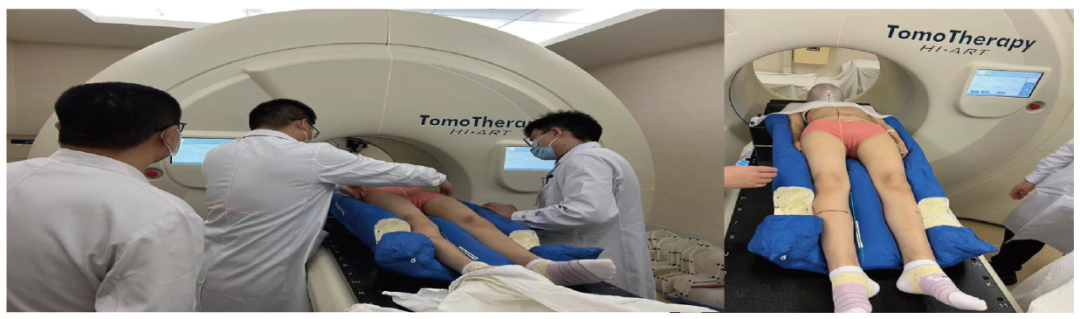
图4 结合TOMO加速器进行TMLI预处理治疗过程图
TMLI:同图1
2.5 治疗效果
患者经治疗后顺利入仓,口腔黏膜反应1级,胃肠道反应2级,给予药物对症支持治疗后好转。至2022年8月随防时病情平稳。
3 讨 论
TBI是一种传统的放射治疗方式,曾在临床中被广泛应用,与非TBI治疗方式相比,其清髓效果更好,累积复发率更低[1]。但因其操作复杂、耗时长、机器损耗大、适形性较差、照射剂量不均匀,对重要的组织器官如晶体、肺、肠道等缺少保护,无法提高放疗剂量,且可能造成相关的晚期毒性,如儿童患者的生长发育障碍、神经认知能力下降、长期内分泌毒性和继发性恶性肿瘤、间质性肺炎、肺损伤等[2],逐渐在临床中被其他治疗方法所替代[3-4]。
TMLI是一种可替代TBI的治疗方式,其更具针对性,可降低35%~70%的正常组织受量,显著降低相关放疗毒性并增加高危患者的骨髓受量[3]。与TBI相比,可降低重要的危及器官受照射剂量,并同时提高受累部位受照射剂量,提高治愈率,降低复发率[5-8]。其可将重要器官如睾丸的受照射剂量降低至0.48 Gy,避免放疗后长期无精子症的风险,可将卵巢的受照射剂量降至1.66 Gy,大大降低卵巢早衰的风险[9]。
Wong等[10]总结了应用TMLI的临床疗效,与TBI相比,未增加髓外复发概率,且在保证移植前预处理疗效的同时,可降低29%~65%的危及器官受量。TMLI的1年无事件生存率(EFS)为65.2%~72%。
Zhao等[4]对比了TMLI组(29例)与非TMLI组(41例)急性淋巴细胞白血病患者的预后情况,结果显示TMLI组1年复发率明显降低(25% 比 46.5%, P=0.018),1年总生存率提高(73.1%比52.6%,P=0.033)。
在儿童患者中也有相关研究,应用TOMO加速器进行TMLI照射,与旋转调强放疗计划相比,取得了较好的预处理效果,降低了肺、肾10%的OAR限量,且随访2.3年未发现肺、肾等重要器官的相关毒副反应[11]。
本例患者为首例应用TMLI进行骨髓移植前预处理的患者,在全流程设计后进行治疗,顺利实现照射,采用发泡胶联合头颈肩网的定位方式,整体治疗过程中患者体感舒适, 照射剂量率(800 cGy/min)与TBI(5~30 cGy/min)相比显著提高。治疗时间(约为45 min~1 h/次)较TBI(3~4 h/次)大大缩短,治疗效率大幅提高[1,12]。
患者顺利入仓,治疗后相关口腔黏膜炎、胃肠道反应均较轻。这与TOMO照射技术及危及器官限量有关,可保护危及器官,实现不同照射剂量梯度要求[13-15]。本例患者诊断时存在左眼内受累,此次治疗过程中实现局部加量至20 Gy,提高了治疗剂量,同时眼、晶体、视神经的危及器官受到较好保护[16-18]。
4 小 结
综上,TMLI预处理治疗是应用先进的放疗技术进行的全身清髓方式,可针对性照射总骨髓和淋巴,并可实现不同剂量梯度照射,同时减少对正常组织器官的照射剂量。治疗过程中患者体感舒适,治疗时间较TBI大大缩短,临床治疗效率高,为后续开展更多患者的治疗提供了全流程及重要参数借鉴。期待后续开展更多患者的治疗,并不断优化各流程所需时间。
参考文献
[1]张红, 邱小平, 杨振, 等. 23例X线全身照射患者的照射方法及剂量学分析[J]. 中国医学物理学杂志, 2011, 28: 3-7.
[2]陈喜林, 张伟京,俞受程,等. 全淋巴区照射在恶性淋巴瘤造血干细胞移植治疗中的放射生物效应和临床应用[J]. 中华放射医学与防护杂志, 2002, 22: 116-117.
[3]Giralt S. TMLI: a better TBI or more of the same?[J]. Blood, 2011, 117: 9-11.
[4]Zhao X, Lu X, Tang L, et al. Comparing the outcomes between TMLI and non-TMLI conditioning regimens for adult high-risk acute lymphoblastic leukemia patients undergoing allogeneic hematopoietic stem cell transplantation: a single-center experience[J]. Leuk Lymphoma, 2020, 61: 2859-2867.
[5]Sarradin V, Simon L, Huynh A, et al. Total body irradiation using Helical Tomotherapy: Treatment technique, dosimetric results and initial clinical experience[J]. Cancer Radiother, 2018, 1: 17-24.
[6]Bao Z, Zhao H, Wang D, et al. Feasibility of a novel dose fractionation strategy in TMI/TMLI[J]. Radiat Oncol, 2018, 13: 248-257.
[7]Paix A, Antoni D, Waissi W, et al. Total body irradiation in allogeneic bone marrow transplantation conditioning regimens: A review[J]. Crit Rev Oncol Hematol, 2018, 123: 138-148.
[8]Mancosu P, Navarria P, Muren LP, et al. Development of an Immobilization Device for Total Marrow Irradiation[J]. Pract Radiat Oncol, 2021, 11: e98-e105.
[9]Dibs K, Sim AJ, Penagaricano JA, et al. Gonadal-sparing total body irradiation with the use of helical tomotherapy for nonmalignant indications[J]. Rep Pract Oncol Radiother, 2021, 26: 153-158.
[10]Wong JYC, Filippi AR, Scorsetti M, et al. Total marrow and total lymphoid irradiation in bone marrow transplantation for acute leukaemia[J]. Lancet Oncol, 2020, 21: e477-e487.
[11]孔凡洋, 蔺亚雷, 刘乐乐, 等. 基于螺旋断层治疗的儿童全骨髓全淋巴照射临床研究[J]. 中华放射肿瘤学杂志, 2018, 10: 5-8.
[12]Chilukuri S, Sundar S, Thiyagarajan R, et al. Total marrow and lymphoid irradiation with helical tomotherapy: a practical implementation report[J]. Radiat Oncol J, 2020, 38: 207-216.
[13]Haraldsson A, Engellau J, Lenhoff S, et al. Implementing safe and robust Total Marrow Irradiation using Helical Tomotherapy-A practical guide[J]. Phys Med, 2019, 60: 162-167.
[14]Shen J, Wang X, Deng D. et al. Evaluation and improve-ment the safety of total marrow irradiation with helical tomotherapy using repeat failure mode and effects analysis[J]. Radiat Oncol, 2019, 14: 238.
[15]Bao Z, Zhao H, Wang D, et al. Feasibility of a novel dose fractionation strategy in TMI/TMLI[J]. Radiat Oncol, 2018, 13: 248-257.
[16]Loginova AA, Tovmasian DA, Lisovskaya AO, et al. Optimized Conformal Total Body Irradiation methods with Helical TomoTherapy and Elekta VMAT: Implementation, Imaging, Planning and Dose Delivery for Pediatric Patients[J]. Front Oncol, 2022, 12: 785917-785924.
[17]Sresty N, Gudipudi D, Krishnam Raju A, et al. Total body irradiation of bone marrow transplant using helical TomoTherapy with a focus on the quality of dose contribution at junction target volumes[J]. Strahlenther Onkol, 2021, 197: 722-729.
[18]许森奎, 姚文燕, 胡江, 等. 基于螺旋断层治疗的全身皮肤照射体位固定新技术初步观察[J]. 中华放射肿瘤学杂志, 2021, 30: 5-10.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言