【ASCO继续教育】AML治疗中的进展与挑战
2024-05-08 聊聊血液 聊聊血液 发表于上海
综述重点关注急性髓系白血病治疗中的最新进展与持续挑战,特别是继发性 AML 的持续挑战和年轻患者的初始治疗,还概述了与靶向治疗相关的常见副作用和毒性及缓解策略。现整理全文供参考。
AML的治疗
《American Society of Clinical Oncology educational book》近日发表综述“Advancements and Challenges in the Treatment of AML”,重点关注急性髓系白血病(AML)治疗中的最新进展与持续挑战,特别是继发性 AML 的持续挑战和年轻患者的初始治疗,还概述了与靶向治疗相关的常见副作用和毒性及缓解策略。现整理全文供参考。

MDS演变为AML时:如何治疗疾病进展
继发性 AML 占 AML 病例的20%-30%,预后和生存结局比原发性(de novo) AML 更差。原发性AML 的1年生存率为65%,非 MDS继发性 AML 为31%,治疗相关 AML(t-AML) 为45%。继发性 AML 在历史上包括由前期血液疾病 (AHD) 或既往细胞毒化疗引起的AML(这是基于临床个体发育学[clinical ontogeny]的区分,可分为原发性和继发性),最近还正式纳入继发性遗传学(即骨髓增生异常相关AML [AML-MR])。这一疾病生物学和遗传学的正式合并使 MDS 和 AML 之间的界限模糊不清,在最近的ELN指南、WHO分类和ICC分类中得到了加强。另一个例子是将 TP53 突变疾病分类为MDS/AML(变体等位基因分数至少为10%且原始细胞为10%-19%的患者),这与TP53 突变AML(原始细胞≥20%)有所不同。MDS进展为 AML 时的治疗选择有限,包括强化疗(IC)(7+3或柔红霉素和阿糖胞苷为基础方案;CPX-351)和去甲基化药物(HMA) 或维奈克拉(VEN) 为基础的低强度策略(包括HMA/VEN、HMA/艾伏尼布和低剂量阿糖胞苷/VEN)。由于 MDS 引起的 AML 在生物学上不同于原发性AML,初始诱导治疗是否应差异化也存在争议。
更新的定义:MDS引起的AML
WHO 2022 分类将继发性 AML 重新定义为继发于细胞毒性治疗(因不相关肿瘤接受DNA损伤治疗或大射野放疗)或生殖细胞系易感的继发性髓系肿瘤,并将其与 AML-MR 进一步区分。AML-MR(之前归类为 AML 伴MDS相关变化)定义为原始细胞≥20%、表达髓系免疫表型、具有特定细胞遗传学(复杂核型;-7、del(5q)、-5或 3q 异常;或+8)、起源于原发性或MDS/MPN重叠综合征病史。在 2022 ELN 指南中,继发性突变危高危特征,包括SRSF2、SF3B1、U2AF1、ZRSR2、ASXL1、EZH2、BCOR和STAG2,可确定与原发性/泛 AML 突变和 TP53 突变 AML 患者不同且临床结局更差的 AML 亚组。734例患者的大型多中心队列证实,AHD史、治疗相关疾病或血细胞计数异常会对生存结局产生独立影响,这与通过 ELN 2022 和 TP53 突变状态测量的疾病相关遗传风险有所不同,提示是疾病遗传学驱动结局而非临床个体发育学。
常规强化疗(IC)方案
对来自 PETHEMA 登记组的765例伴继发性或髓样相关变化的 AML 患者(年龄60-75岁)的真实结局进行回顾性分析,结果显示,CPX-351 上市前,常规IC的不同类型无显著差异。所有强化方案(不包括CPX-351)的完全缓解 (CR)/CR 伴不完全计数恢复 (CRi) 率为48%,中位 OS 为7.6个月,无事件生存期 (EFS) 为2.7个月。生存期获益仅限于接受异基因干细胞移植 (allo-SCT) 或一个以上化疗周期的患者。
CPX-351是阿糖胞苷和柔红霉素的脂质体制剂,用于在接受细胞毒性、放疗或免疫抑制治疗后诊断为 AML 的患者,以及伴MDS相关突变的 AML 患者,III 期试验证实生存获益。比较 CPX-351与标准7+3化疗的III期关键试验表明,CR/CRi率分别为47%和33%,中位 OS 分别为9.6和5.9个月。CPX-351还改善缓解后 allo-SCT 率,并且从移植日期开始的 OS 探索性界标分析证实,CPX-351与7+3相比可使生存期获益(风险比[HR]=0.46,P=0.009)。至第60天,CPX-351组与7+3组的早期死亡率分别为13.7%和21.2%(P=0.097)。尽管 CPX-351 取得了适度改善,但鉴于常规IC方案的总体治疗相关发病率和死亡率,存在无法通过缓解后治疗(即移植或巩固)进行巩固的风险,而巩固治疗可降低继发性 AML 的疾病复发风险。对于无法接受 CPX-351 作为缓解后移植或巩固治疗的继发性 AML 患者,替代治疗选择包括口服 AZA(CC-486) 维持治疗,其已在 III 期 QUAZAR 研究的基础上获得批准。尽管继发性 AML 患者的比例相对较低(43/472例患者,9%),但单因素分析证实,与安慰剂相比,CC-486组有生存期获益。
低强度化疗方案
对于因年龄(>75岁)或合并症(虚弱)无法接受常规 IC 的患者,HMA单药治疗不再是首选。3项 III 期研究改变了其一线治疗选择,包括 AZA 联合VEN(VIALE-A研究)、低剂量阿糖胞苷联合VEN(VIALE-C研究)和AZA联合艾伏尼布(AGILE研究,针对 IDH1 突变AML),与对照组相比具有生存获益。
在 VIALE-A 研究中,继发性 AML 患者(包括有 MDS/CMML 史或治疗相关AML患者)比例适中,包括 AZA/VEN 组25%的患者和AZA/安慰剂组24%的患者。亚组分析证实AZA/VEN 组有生存获益(HR=0.56)。VIALE-C研究纳入相对较多的继发性AML患者(38%), 20%的患者既往接受过HMA治疗。与继发性AML患者相比,原发性AML患者的生存率更高(HR=0.59,P=0.004)。AGILE研究中,研究组25%的患者和对照组28%的患者为继发性AML。继发性AML患者(在亚组分析中定义为非原发性)与AZA/安慰剂相比,并未显著受益于研究性AZA/艾伏尼布。
近年来,由于MDS引起的AML的基因学定义越来越明确,回顾性分析提供了更深入研究患者亚群的机会,这些患者可能受益于临床个体发育学之外的选择治疗。一项纳入395例分子学定义的继发性AML患者的多中心回顾性研究显示,各治疗组之间的复合CR率相似:7+3组为56%,HMA/VEN组为56%,CPX351组为44%;P=0.22。所有患者的中位OS为16个月且各组之间存在差异(7+3组为22个月;HMA/VEN组为15个月;CPX-351组为12个月, P=0.037),但年龄调整后后>75岁患者中无差异。395例患者中237例为60-75岁,其OS无差异:7+3(16个月)、HMA/VEN(16个月)和CPX-351(10个月),P=0.78。严格的逐步多因素分析控制患者、疾病和治疗特征,发现HMA/VEN相对于7+3可改善OS(HR=0.64,P<0.05)。随后,另外两项研究证明,在接受 HMA/VEN 治疗的患者中,剪接突变和分子学定义的继发性个体发育学突变伴或不伴切片突变相关的高危患者的生存获益改善。
异基因造血干细胞移植(Allo-SCT)
Allo-SCT是最初缓解后推荐和首选的巩固治疗策略,以提高长期生存的机会。对644例继发性或治疗相关AML和原发性AML的回顾性分析显示,累积复发发生率相似,但继发性AML的非复发死亡率(NRM)更高,生存期更短。但按ELN中危组和高危组分类分析时差异不再显著,可能是因为队列规模较小。在EBMT注册组研究中,11439例原发性AML和1325例继发性AML患者,后者的OS较短(HR=1.33 ,P<1025)和NRM较高 (HR=1.37,P<1024),证实继发性AML是首次缓解期(CR1)移植后预后不良的独立风险因素。新诊断高危/继发性AML中对比CPX-351与7+3诱导化疗的III期研究中,移植巩固的长期随访部分包括309例患者中的92例(cpx-351组53例, 7+3组39例), 移植后的中位OS分别为未达到和10.3个月(HR=0.51)。该研究是证明移植前诱导类型影响移植后结局的少数研究之一。尽管移植前持续疾病负荷仍会对移植后结局产生负面影响,但不应阻碍移植。即使使用减低强度预处理,但血液和骨髓移植临床试验网络1102研究的突变分析证实,与非移植相比,TP53突变患者的移植生存率提高了20%,即使在移植前存在持续的分子学疾病负荷的患者中也是如此。
治疗手段需要尽快发展的患者亚群
TP53突变患者和既往接受HMA治疗前期MDS的患者仍然易患难治性和复发性疾病,并且通常没有从上述任何新型治疗中获益。在可能的情况下,考虑到具有新的作用机制的药物或三联疗法(HMA/VEN+新药),参加临床试验仍然是缓解诱导的首选治疗选择。异基因细胞移植仍是推荐的缓解后治疗,且在临床试验中同样是首选,特别是对于接受非清髓性预处理的患者。
对于年轻AML患者,强化疗与否?
在2017年之前,所有fit初治非APL AML 患者的标准治疗都是阿糖胞苷和蒽环类药物为基础的强化诱导化疗(例如7+3或类似方案)。但自2017年以来,随着11种新药的批准,AML的治疗格局发生了巨大变化(图1)。虽然IC 仍是大多数年轻 AML 患者的一线治疗选择急剧增加,近些年一线治疗的选择也不断增加。全面的基因组特征对于选择最佳初始治疗至关重要。AML的标准诊断检查包括骨髓 (BM) 活检及形态学评估、免疫表型分析、染色体分析、荧光原位杂交排除 APL 和评估常见染色体异常,以及分子检测(包括二代测序panel)。
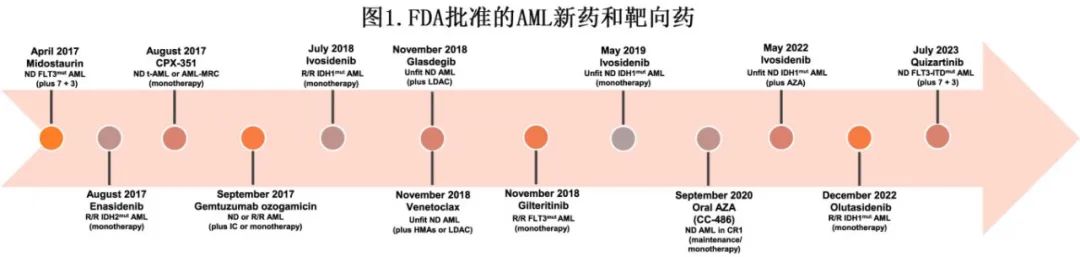
年轻成人新诊断AML 患者的治疗取决于疾病生物学和患者特征,如体能状态和合并症。ELN风险分层系统根据细胞遗传学和分子学突变将患者分为预后良好(低危)、预后中等(中危)和预后不良(高危)。在2022年更新中对 ELN 风险分层进行了多项重要变更。值得注意的是,目前认为携带 FLT3-内部串联重复 (ITD) 突变的 AML 为中危(无高危特征时)。
简而言之,年轻患者的治疗包括诱导缓解治疗和缓解后的巩固化疗和/或Allo-SCT。对于低危患者,通过强化诱导和巩固化疗可获得长期无病生存甚至治愈。巩固治疗完成后存在持续可测量残留病灶 (MRD) 可高度预测复发,可用于指导哪些低危患者应CR1 进行allo-SCT。对于高危AML患者,CR1期均建议进行allo-SCT,以获得最佳的长期生存。对于中危患者,Allo-SCT的决策应高度个体化,但通常建议移植,特别是对于 FLT3-ITD 突变AML。
FLT3抑制剂
大约30%的 AML发生 FLT3-ITD 和TKD突变,FLT3-ITD和 TKD 突变均可引起 FLT3 及其下游信号通路的组成性激活。与 FLT3 野生型 AML 相比,FLT3-ITD突变历来与预后较差相关,很大程度上是由于复发风险增加。但随着近年来FLT3 抑制剂一线结合IC 和CR1期Allo-SCT增多,FLT3 突变患者的结局也显著改善。
Midostaurin是一种口服非特异性多激酶 FLT3 抑制剂,对蛋白激酶c、KIT和其他激酶具有抑制活性。在 III 期 RATIFY 研究中,717例新诊断FLT3 突变 AML(FLT3-ITD/TKD) 年轻患者(≤59岁)随机分配接受标准IC 联合Midostaurin或安慰剂。尽管两组之间的 CR 率没有差异 (58.9% vs 53.5%,P=0.15),但Midostaurin组的OS(HR=0.78;P=0.009) 和EFS(HR=0.78;P=0.002) 显著改善。
Quizartinib和吉瑞替尼是更强效和选择性的FLT3 抑制剂。QuANTUM-First III 期研究中,539例患者(18-75岁)随机分配在标准 IC 的基础上接受Quizartinib(40 mg,每日一次,每个周期14天)或安慰剂。与安慰剂组相比,Quizartinib组的 OS 显著改善(31.9 vs 15.1个月;HR=0.78;P=0.032),但事后亚组分析表明,Quizartinib组的生存获益仅限于<60岁患者。吉瑞替尼联合 IC 治疗新诊断AML也是安全的。
尚未直接比较Quizartinib和Midostaurin。一个重要的区别在于Quizartinib特异性靶向 FLT3-ITD 突变,而Midostaurin对 FLT3-ITD 和 TKD 突变均有活性。一项随机 II 期研究(NCT03836209)评价了吉瑞替尼(同时靶向 FLT3-ITD 和 TKD 突变)联合IC或Midostaurin联合IC,而一项正在进行的 III 期研究(NCT03258931)正在比较选择性 FLT3 抑制剂crenolanib联合标准化疗与Midostaurin联合标准化疗。所有 FLT3-ITD 患者均应接受早期移植评估。
维奈克拉
VIALE-A 研究随机分配高龄(≥75岁)或因合并症或体能状态下降而不适合IC 的新诊断AML 患者接受 AZA/VEN vs AZA/安慰剂,CR/CRi率 (66.4% vs 28.3%;P<0.001) 和中位OS(14.7 vs 9.66个月;P<0.001)均显著改善。表明HMA+VEN可作为老年或不适合IC的 AML 患者一线治疗的新标准治疗。临床试验不可用时,HMA/VEN 可用于不适合 IC (基于Ferrara标准或体能状态差)的年轻新诊断AML 患者。
除年龄和fitness外,越来越多的人关注将 HMA/VEN 纳入年轻 AML 患者的一线治疗,尤其是 IC 治疗不太可能有效的高危患者,以避免额外的治疗相关毒性。与 IC 相比,HMA/VEN方案还具有住院时间缩短和毒性降低的潜在获益。一项42例患者研究评价了地西他滨和联合VEN 作为一线治疗在<60岁、2017 ELN高危、成人AML中的疗效,CR率为81%(34/42例),12个月 OS 率为82%。大多数接受了 Allo-SCT 巩固 (36/42;86%)。虽然该小型单臂研究的结果很有前景,但尚无长期随访。其他几项正在进行的研究也在年轻患者中评价 HMA/VEN 方案,包括一项随机 II 期研究在既往未经治疗的适合诱导治疗AML(不包括低危AML)中比较 AZA/VEN 与7+3,以 EFS 为主要终点(NCT04801797)。
值得注意的是,虽然 HMA/VEN 可持久缓解,但并非治愈性方案。最近报告了罕见的例外情况,但并不代表大多数。接受 HMA/VEN 治疗的年轻患者应评估巩固性移植,这就是为什么低危患者(可能通过 IC 治愈)通常从当前研究中排除。多项回顾性研究评估了HMA/VEN 治疗后移植的结局。一项单中心研究比较了 IC 与 HMA/VEN 一线治疗后 CR1 期移植的结局,发现两者的无复发生存期、OS或移植物抗宿主病无差异。但是,该研究受到其回顾性性质、与 IC组(n=140) 相比 HMA/VEN组数量较少 (n=29) 以及随访时间较短的限制。需要在一线 HMA/VEN 后移植的年轻/fit患者中开展前瞻性研究,以评价长期结局。
VEN 还与 IC 联合进行研究。一项氟达拉滨、阿糖胞苷、粒细胞集落刺激因子和伊达比星联合 VEN 的 I/II 期研究 (FLAG-Ida +VEN) 入组68例新诊断AML(n=29) 或复发性/难治性 (R/R)AML(n=39) 患者。新诊断队列的总缓解率 (ORR) 为97%(28/29),CR率为69%(20/29),而 R/R 队列ORR为71.8%(28/39),CR率为43.6%(17/39)。在所有达到 CR/CRi 的患者中,MRD阴性率较高(多参数流式细胞术分析显示,新诊断队列中为96%,复发/难治性队列中为69%)。但也要考虑毒性,尤其是在 R/R 患者和接受1个周期以上治疗的患者中观察到显著的骨髓抑制和长期中性粒细胞减少症。另一项使用克拉屈滨、伊达比星和阿糖胞苷联合VEN 的研究 (CLIA+VEN) 中观察到类似结果。一项正在进行的 VEN 加7+3的研究中报告了初步安全性数据(NCT03709758)。
其他靶向药物
Menin 抑制剂是一种新型靶向药物,正在开发用于治疗 KMT2A 重排 (KMT2Ar) 和 NPM1 突变AML,也可能对某些其他 AML 亚群(即 NUP98 重排)有效。临床开发中的几种 menin 抑制剂在 R/RKMT2AR 和 NPM1 突变 AML 中具有良好的初步单药疗效。一项口服 menin 抑制剂 revumenib 治疗 NPM1 突变 AML 或 KMT2Ar-急性白血病 R/R 患者 (N=68) 的 I 期研究发现,ORR率为53%(32/60),CR/CR伴部分血液学恢复率为30%(18/60)。16.2%的患者中发生分化综合征 (DS)但均为≤2级。临床试验目前正在评估 menin 抑制剂同事联合强化和低强度方案。例如,KOMET-007研究(NCT05735184)正在评估 menin 抑制剂 ziftomenib 联合7+3和AZA/VEN。
Gemtuzumab Ozogamicin
Gemtuzumab Ozogamicin (GO) 是一种与刺孢霉素连接的抗 CD33 抗体-药物偶联物,最初获批作为单药治疗,因验证性研究结果为阴性且担心毒性过大和死亡而停药,随后于2017年获批与 IC 联合治疗新诊断AML。一项纳入5个随机研究的关键性荟萃分析评价了在一线化疗中添加 GO,在低危细胞遗传学(t(8;21) 或inv(16)/t(16;16) 核心结合因子 [CBF] 重排)的患者中添加 GO 的获益最大,6年时的绝对生存获益为20.7%。这是由于复发风险降低所致,因为 CR 率没有差异。在中危细胞遗传学患者中观察到的生存获益较小(6年时绝对生存获益为5.7%),而在高危细胞遗传学患者中未观察到获益。
作者目前的方法是在 IC 中添加GO,用于所有适合诱导治疗的 CBF-AML 患者。根据德国-奥地利 AML 研究组在588例 NPM1 突变 AML 患者中比较单纯化疗(伊达比星、阿糖胞苷、依托泊苷和全反式维甲酸)或联合GO的结果,在不存在并发 FLT3-ITD 突变或高危细胞遗传学的情况下,NPM1突变 AML 患者也可考虑在 IC 基础上加用GO。尽管 GO 组患者的2年复发率显著较低(GO组的复发率为25%,对照组为37%,HR=0.65;P=0.0028),但未达到 OS 或 EFS 改善的主要终点。尽管复发率较低,但 GO 治疗可能无法改善OS,因为复发性 NPM1 突变 AML 通常对挽救治疗反应良好。
新型联合用药相关毒性的管理
随着治疗药物的扩展和新型联合治疗的开发,了解与这些药物相关的不良事件 (AE) 以及减轻和管理毒性的策略对于最佳治疗至关重要。本部分重点关注联合治疗中添加的小分子抑制剂的主要毒性。
维奈克拉
HMA/VEN骨髓抑制
根据其毒性特征和无限期治疗,HMA/VEN应归类为中等强度而非低强度方案。在 VIALE-A 研究中,最常见的≥3级 AE 包括血小板减少症 (45%)、中性粒细胞减少症 (42%)、发热性中性粒细胞减少症 (42%) 和感染 (64%)。需要逐步调整剂量以降低感染和长期骨髓抑制的风险,措施包括周期之间延迟给药、缩短每个周期的 VEN 给药持续时间以及 VEN 与伴随药物的适当剂量调整(图2)。应在第1周期第21天和第28天之间进行 BM 评估,以确定第2周期的开始和所需的 VEN 持续时间。持续性 AML 患者(BM原始细胞≥5%)应继续接受 VEN 治疗而不中断,并按时开始第2周期,不考虑血细胞减少。在这些患者中,应在周期2后重复 BM 评估,以重新评估治疗反应。2个周期后无缓解应提示治疗变化(但最晚可在4个周期时观察到有意义的缓解)。然而,如果在第1周期后达到形态学缓解(BM原始细胞<5%和/或骨髓细胞<10%)且伴有持续性血细胞减少则应暂停 VEN 给药,并延迟第2周期最长达14天,以使血细胞计数恢复(中性粒细胞绝对计数 [ANC]≥0.5x109/L和血小板≥50x109/L)。后续周期应逐步缩短 VEN 的持续时间(即28天/周期→21→14→7天),以降低长期骨髓抑制的风险。如果治疗中断后血细胞减少持续超过2-3周,则需要重复进行 BM 评估,以评估疾病状态。
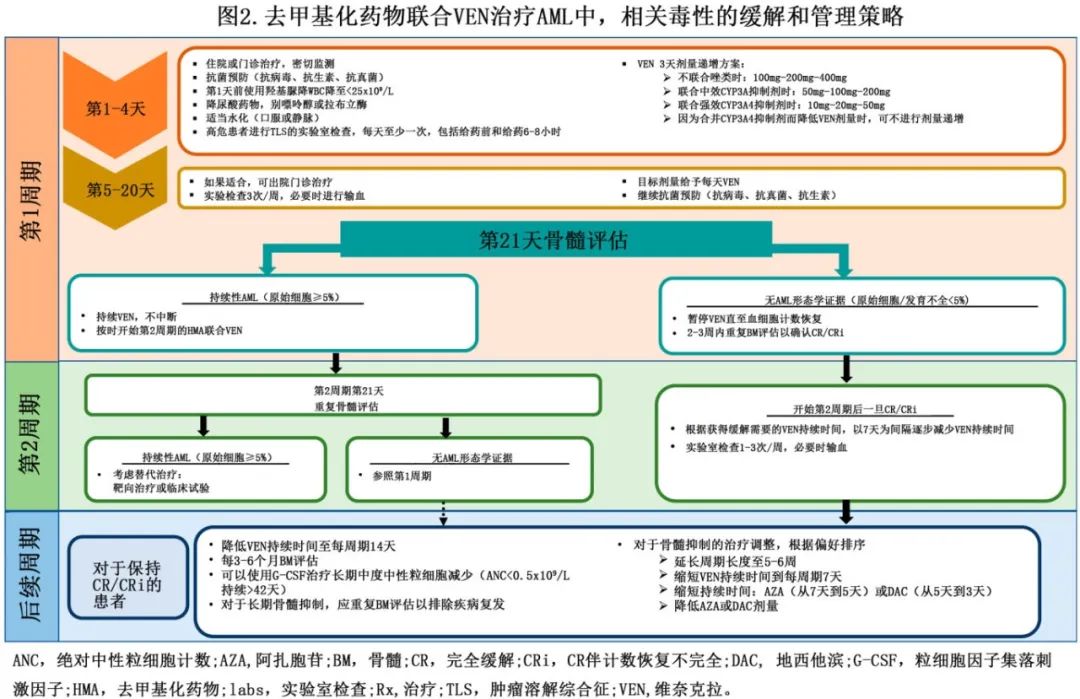
由于治疗可能无限期,因此在发生长期血细胞减少时可能需要进一步逐步调整剂量,例如 (1) 将周期长度延长至5-6周,(2) 将 AZA 或地西他滨的治疗持续时间分别缩短至每个周期5天或3天,和 (3) 降低 AZA 剂量至 50 mg/m2 每日一次(然后至37.5 mg/m2每日一次或 25 mg/m2每日一次)和地西他滨剂量至 15 mg/m2每日一次(然后至 10 mg/m2每日一次)。缓解后,如果发生长期重度中性粒细胞减少症(定义为从周期开始ANC<0.5x109/L持续>42天)可使用粒细胞集落刺激因子 (G-CSF)。建议在治疗开始时进行抗菌预防,以降低感染风险。由于 VEN 是细胞色素 P450 3A(CYP3A4) 和 P-糖蛋白酶的底物,因此与 CYP3A4 和 P-糖蛋白抑制剂(如唑类)联合时要调整VEN剂量。初始药代动力学研究表明,与 CYP3A4 强抑制剂合用时,VEN的剂量应降低75%,与 CYP3A4 和 P-糖蛋白中效抑制剂合用时,VEN的剂量应降低50%。然而随后的药代动力学研究表明,当与强效 CYP3A4 联合给药时,VEN的剂量应从 400 mg 每日一次降低至 50 mg 每日一次。预防性抗真菌治疗应根据区域感染率给药。
对于每个周期来说,维持疗效的同时限制毒性所需的最佳 VEN 持续时间,在很大程度上仍不清楚。VIALE-A研究的长期随访表明,使用 AZA/VEN 达到 CR/CRi 的患者 (191/282;68%) 的周期中位持续时间为5周,VEN 中位给药持续时间为21天/周期(从周期6开始为15-21天)。有回顾性研究评估 HMA 联合14或28天 VEN 的结局,结果显示两组之间的 CR/CRi 率和 OS 无显著差异,而14天VEN的感染更少,因此VEN联合 14 天HMA可能同样有效,但更安全。一项正在进行的随机 II 期研究评估AZA 联合14天与28天 VEN 在 新诊断AML 患者中的疗效和安全性(NCT03013998)。
肿瘤溶解综合征
在 AML 中,HMA/VEN的肿瘤溶解综合征 (TLS) 发生率较低,仅1%,主要是因为在治疗开始时采取了积极的预防措施。预防 TLS 的措施包括:(1) 在治疗开始前用羟基脲将 WBC 降至<25x109/L,(2) 短时间递增VEN至目标剂量,(3) 在剂量递增期间充分水化并使用降尿酸药物, (4) 对于高危患者,在每次新剂量 VEN 给药前和每次新剂量给药后6-8小时,至少每天进行一次 TLS 实验室检查。尽管保守且最广泛采用的方法是让患者住院至少3-5天以监测TLS,但特定无 TLS 风险因素的患者可在门诊中应用上述预防措施安全地开始治疗。在实践中,作者未观察到全剂量 VEN 下具有临床意义的TLS。对于TLS低危患者,无需递增剂量,尤其当唑类药物合并用药而减量时。
IDH1/2 抑制剂
有三种 IDH1/2 抑制剂获批作为 IDH1/2 突变AML的单药治疗,包括 IDH2 抑制剂 enasidenib[R/R AML] ,IDH1 抑制剂艾伏尼布[新诊断和 R/R] 和olutasidenib[R/R AML])。IDH1/2 突变 AML 患者达到的持久缓解。特别关注的 AE 包括DS、白细胞增多症和 QTc 间期延长。
分化综合征
分化综合征(Differentiation Syndrome,DS)是一种与 IDH1/2 抑制剂相关的重要且潜在致死性AE,因为IDH1/2 抑制剂可抑制突变型 IDH1/2 酶,可降低 2-HG 水平并诱导 IDH 突变型骨髓芽细胞分化。DS的特征为呼吸困难、不明原因的发热和/或低血压、体重增加、体液潴留、急性肾衰竭、肺部炎症或胸膜心包积液。使用 IDH1/2 抑制剂时,DS的发生率范围为13%-25%(≥3级:5%-9%),而死亡和永久停药的发生率极低。DS的中位发生时间为19-20天(1-86天),最早可能发生在治疗开始后6-18个月。约30%的患者报告伴随白细胞增多症。
DS 的早期识别和管理是预防严重并发症和死亡的关键。一旦怀疑DS,应立即开始地塞米松 10mg 每日两次治疗,至少持续3天,直至症状消退。羟基脲用于同时发生白细胞增多的患者。根据临床指征,可使用其他支持性措施,如使用利尿剂治疗容量超负荷,使用抗生素治疗并发感染。缺氧、肾功能不全和 WBC 计数迅速升高的患者需要住院。由于其半衰期较长,中断 IDH1/2 抑制剂给药无法立即逆转 DS 症状;除非患者发生重度 DS 或对至少48小时的地塞米松治疗无应答,否则不建议中断 IDH1/2 抑制剂。
其他特别关注的 AE
由于对 UGT1A1 酶(负责胆红素葡萄糖醛酸化)的脱靶抑制,Enasidenib可引起自限性无症状性间接高胆红素血症(约35%)。艾伏尼布治疗的患者中QTc间期延长的发生率为18%-26%。允许在密切监测 ECG 和电解质的情况下合并使用延长 QTc 间期的药物。如果 QTc 间期为>480至<500ms则需要中断治疗,QTc间期>500ms则需要减量。25%接受 olutasidenib 治疗的患者发生肝毒性,≥3级约15%;3级肝毒性可通过中断治疗和减量进行管理,4级毒性建议永久停药。
AZA联合IDH抑制剂
在 AGILE 研究中,在不适合IC 治疗的新诊断IDH1 突变 AML 患者中,AZA/艾伏尼布与 AZA/安慰剂相比显著改善EFS(HR=0.33)、CR/CRi率 (53% vs 18%) 和中位OS(24 vs 7.99个月)。AZA/艾伏尼布的安全性特征比 AZA/安慰剂更佳,原因包括:(1)ANC 恢复和 BM 原始细胞下降更快,(2) 发热性中性粒细胞减少症 (28 vs 34%) 和感染 (28 vs 49%) 的发生率更低,(3) 摆脱输血依赖 (46 vs 17.5%) 的比例更高。
AZA/VEN 在 IDH1 突变 AML 中具有疗效,CR/CRi率为67%,中位 OS 为15.2个月。然而与 AZA/艾伏尼布相比,AZA/VEN的发热性中性粒细胞减少症和感染的发生率相对较高,这对于老年 AML 患者尤其重要。AZA/艾伏尼布的有利安全性特征以及更长的中位 OS 29.3个月,使其成为unfit IDH1 突变 AML 一线治疗的有力选择。但应谨慎解释研究间的比较。还需要更多研究比较 AZA/VEN 和 AZA/艾伏尼布或三联治疗的一线和序贯使用。
在unfit初治IDH2 突变 AML 患者中进行的 1b/2 期研究中,与 AZA 单药相比,AZA/enasidenib显示出显著的 CR/CRi 率改善 (63% vs 30%),而 EFS 和 OS 未改善。鉴于 IDH2 突变 AML 对 AZA/VEN 高度敏感(CR/CRi率86%;中位OS未达到),且 AZA/enasidenib 治疗后缺乏 OS 获益,AZA/VEN仍是unfit IDH2 突变 AML 的一线治疗药物。
FLT3抑制剂
Midostaurin
Midostaurin存在胃肠道毒性,包括恶心、呕吐和腹泻。为了克服这些AE,其应与食物同服,每次给药前应安排预防性止吐药,给药前应将药丸暴露空气10-15 min,以减少引起恶心的气味。除了在 RATIFY 研究中观察到IC +Midostaurin的生存获益外,在随后的 II 期研究中,在<70岁的初治FLT3-ITD 突变 AML 患者中也观察到类似 EFS 获益。尽管 AE 与 RATIFY 研究相似,但在老年患者(61-70岁)中心脏毒性的发生率更高 (22% vs 6%)。因此,建议在这些患者中密切监测 ECG 和电解质。
吉瑞替尼
吉瑞替尼是一种口服、强效、选择性 FLT3/AXL1 抑制剂,与挽救化疗相比可显著改善OS(9.3 vs 5.6个月)和复合 CR(CRc) 率 (54% vs 21.8%)。特别关注的 AE 包括DS、QTc间期延长和可逆性后部脑病综合征 (posterior reversible encephalopathy syndrome,PRES)。有3%的患者在治疗开始后2-75天报告DS,其表现和管理与前文相似,但在某些情况下可伴随皮疹或中性粒细胞性皮肤病。PRES是一种罕见的严重AE(1%),一旦确认就要求永久停用吉瑞替尼。
尽管吉瑞替尼单药对 R/R FLT3 突变 AML 具有疗效,但复发较为常见,2年 OS 率约为20%。在 R/R FLT3 突变 AML 患者中评估了VEN联合吉瑞替尼双药方案,其改良CRc 率为75%且既往使用 FLT3 抑制剂的患者可维持缓解。考虑到这些是既往接受过多线治疗的患者人群(64%既往使用过 FLT3 抑制剂),该结果优于 ADMIRAL 研究。骨髓抑制是主要的3/4级AE,约50%的患者需要治疗中断治疗。由于高缓解率,该双药方案越来越多地用于 R/R FLT3 突变AML。达到形态学缓解后的骨髓抑制的管理建议包括:将后续周期延迟至ANC >0.5x10 9/L和血小板>50x10 9/L,长期血细胞减少(>42天)时将 VEN 的持续时间缩短至14-21天/28天周期,将周期长度延长至6周,使用G-CSF 治疗长期重度中性粒细胞减少症,将吉瑞替尼的剂量减少至 80mg 每日一次。
FLT3-ITD 是HMA/VEN 的一种耐药机制,在unfit患者的一线治疗中尚未确立 FLT3 抑制剂的作用。吉瑞替尼/VEN的活性及与 AZA 的协同作用使 AZA/VEN/吉瑞替尼在 FLT3 突变 AML 患者中探索。在unfit初治FLT3突变AML中,AZA/VEN/吉瑞替尼(80 mg每日一次)在96%的患者中诱导CR/CRi,18个月 OS 率为72%。最常见的≥3级非血液学 AE 为感染 (53%) 和发热性中性粒细胞减少 (33%)。有患者发生长期骨髓抑制,其缓解策略如下:(1) 在第1周期第14天进行 BM 评估,如果处于病理性缓解状态,则暂停 VEN 和吉瑞替尼直至血细胞计数恢复;(2) 一旦CR,在后续周期中给予缩短剂量的AZA(5天)和VEN(7天)。一项更大型的多中心研究正在进行中 (NCT05520567),在unfit初治 FLT3 突变 AML 患者中进一步评估该三药方案。
Quizartinib
虽然Quizartinib获批联合 IC治疗18-75岁初治FLT3-ITD 突变 AML 患者,但事后分析显示,生存获益仅限于<60岁患者。老年患者(60-75岁)的早期死亡风险似乎更高。因此,尽管获批的年龄长达75岁,但强烈建议≥60岁患者应慎用该联合治疗(最好避免)。与Quizartinib相关的主要 AE 包括 QTc 间期延长、血细胞减少、低钾血症和感染。在 QuANTUM-First 研究中,14%的患者发生 QTc 间期延长,无尖端扭转型室性心动过速病例,但2例患者死于心脏停搏。因此必须了解风险缓解措施,包括 ECG 和电解质监测、避免合并使用 QTc 延长药物和剂量调整/中断的指征。尽管在 quizartinib 单药治疗中报告了DS,但QuANTUM-First研究中未观察到DS。
结论
近年来,随着多种新型靶向药物的获批,AML的治疗得到了迅速发展。尽管取得了这些进展,但继发性 AML 仍是一个明显未满足的需求领域,对现行标准治疗方案的反应较差,预后不佳,需要开发创新疗法。考虑到 AML 已有各种强化和低强度方案,年轻患者应根据疾病特征(包括细胞遗传学和分子特征,尤其是FLT3、NPM1、IDH1/2和 TP53 突变)进行个体化治疗。Allo-SCT仍是继发性、高危原发性和部分中危 AML 患者根治性治疗的基石,尤其是携带 FLT3-ITD 突变的患者。对于当前和新出现的HMA和 VEN 为基础的两药和三药治疗方案,密切监测和适当调整剂量对于成功治疗及优化反应至关重要。
实际应用
- AML 的治疗前景正在迅速发展,应尽可能考虑参加临床试验和同种异体干细胞移植,尤其是对于骨髓增生异常综合征后出现不良风险疾病或 AML 的患者
- 应获得遗传疾病特征,以讨论最佳治疗决策
- 对于新诊断fit AML 患者,在诱导治疗的基础上加用midostaurin或quizartinib可改善 FLT3 突变患者的生存期。对于核心结合因子 (CBF)AML 患者,加用gemtuzumab ozogamicin可降低复发风险
- 去甲基化药物联合维奈克拉已成为新诊断 AML老年/unfit患者的新标准治疗,可能需要逐步减量/调整剂量,以降低长期骨髓抑制风险
- AZA/艾伏尼布是一种有效的治疗方案,具有良好的安全性特征,使其成为unfit IDH1 突变 AML 一线治疗的有力选择
参考文献
Abaza Y, et al.Advancements and Challenges in the Treatment of AML.Am Soc Clin Oncol Educ Book . 2024 Apr;44(3):e438662. doi: 10.1200/EDBK_438662.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















现在aml的疗效已经取得了很好的进步
5
#AML# #急性髓系白血病#
9