AMERICAN JOURNAL OF PATHOLOGY:通过深度学习预测胃癌患者免疫治疗反应的分子特征
2023-09-25 MedSci原创 MedSci原创 发表于上海
基于深度学习的模型可能成为筛选胃癌患者免疫治疗受益人的宝贵工具。
胃癌(GC)在全球最常见的癌症类型中排名第五,是第四大癌症相关死因。大多数患者在诊断时已经处于晚期,特别是在亚洲国家。在GC的致癌和进展过程中,不同的患者表现出不同的分子表型特征。单个患者陈述之间的高异质性使得标准化GC的一般治疗具有挑战性。因此,GC的精确治疗需要个性化的治疗方案。最近,基于分子和免疫学特征的免疫治疗已被证明对GC患者有效。因此,系统检测特定的分子改变将为GC治疗提供更有意义的指导。

基于对分子信息的综合分析,癌症基因组图集(TCGA)团队提出了一个分类系统,将GC患者分为四种分子亚型:爱泼斯坦-巴尔病毒(EBV)阳性(+)、微卫星不稳定(MSI)、基因组稳定和染色体不稳定,其中MSI和EBV(+)患者具有更好的免疫治疗效果。此外,EBV(+)、MSI、肿瘤突变负担(TMB)和程序性细胞死亡配体1(PD-L1)已被列入国家综合癌症网络GC指南中,TMB和PD-L1也被列入世界卫生组织消化系统肿瘤分类的第五版,作为免疫检查点阻断治疗反应的生物标志物。
此外,许多研究表明,免疫治疗的疗效与基因突变有显著相关性。从之前的研究结果中,已知KRAS突变通常诱导更好的宿主免疫反应,伴随着对程序性细胞死亡蛋白1(PD-1)/PD-L1抑制剂和更多肿瘤免疫细胞浸润的更好反应;PIK3CA突变状态是GC免疫治疗策略的潜在生物标志物,通常与EBV(+)(免疫治疗敏感亚型之一)一起呈现。TP53突变对肿瘤免疫微环境产生影响,促进癌细胞更好地逃避免疫攻击,这可能对癌症免疫治疗的管理决策产生重要影响。
MUC16突变与更高的TMB和免疫反应有关,这也可以指导GC患者的免疫治疗。此外,反映参与免疫调节的多个分子之间相互作用的信号通路也可以作为个性化免疫治疗的目标。因此,对识别分子目标的需求越来越大,以分层癌症患者进行精确治疗。然而,由于成本高昂和技术障碍,一些癌症患者无法进行许多分子测试,包括下一代测序和免疫组化学,仍然有限。
深度学习(DL)是一种分析数字全幻灯片图像(WSI)的高效方法,它可以提供一种计算有效的方法,为组织病理学图像的更高级数字分析铺平道路。11先前的研究已经确定,癌症组织的形态特征可以反映患者的潜在分子改变。作为病理学中最常见的染色方法之一,血红素和伊红素(H&E)染色可以帮助对肿瘤组织幻灯片进行组织病理学评估,以诊断癌症。
最近的几项研究表明,深卷积神经网络可以直接预测肿瘤切片的H&E WSIs的分子改变。这种有前途的方法有可能在精确癌症治疗时代提供具有成本效益和时间效益的替代工具,仅基于图像分析来指导个性化临床治疗。然而,以前的研究主要侧重于调查单个或几个指标,到目前为止,使用H&E组织幻灯片的信息对分子特征进行彻底评估是罕见的。文献分析表明,组织学相关性的检查分子特征通常是主观进行的,缺乏客观的测量。
2023年9月15日发表在AMERICAN JOURNAL OF PATHOLOGY的文章,系统地评估了关键的分子特征,如免疫治疗敏感亚型、基因突变和通路活性。构建DL模型是为了直接从多种族GC患者的H&E染色WSI中识别个性化免疫治疗的受益者。此外,还使用核段模型对分子特征的预测是否可以映射到已知或新的组织学和微环境特征进行了定量分析。
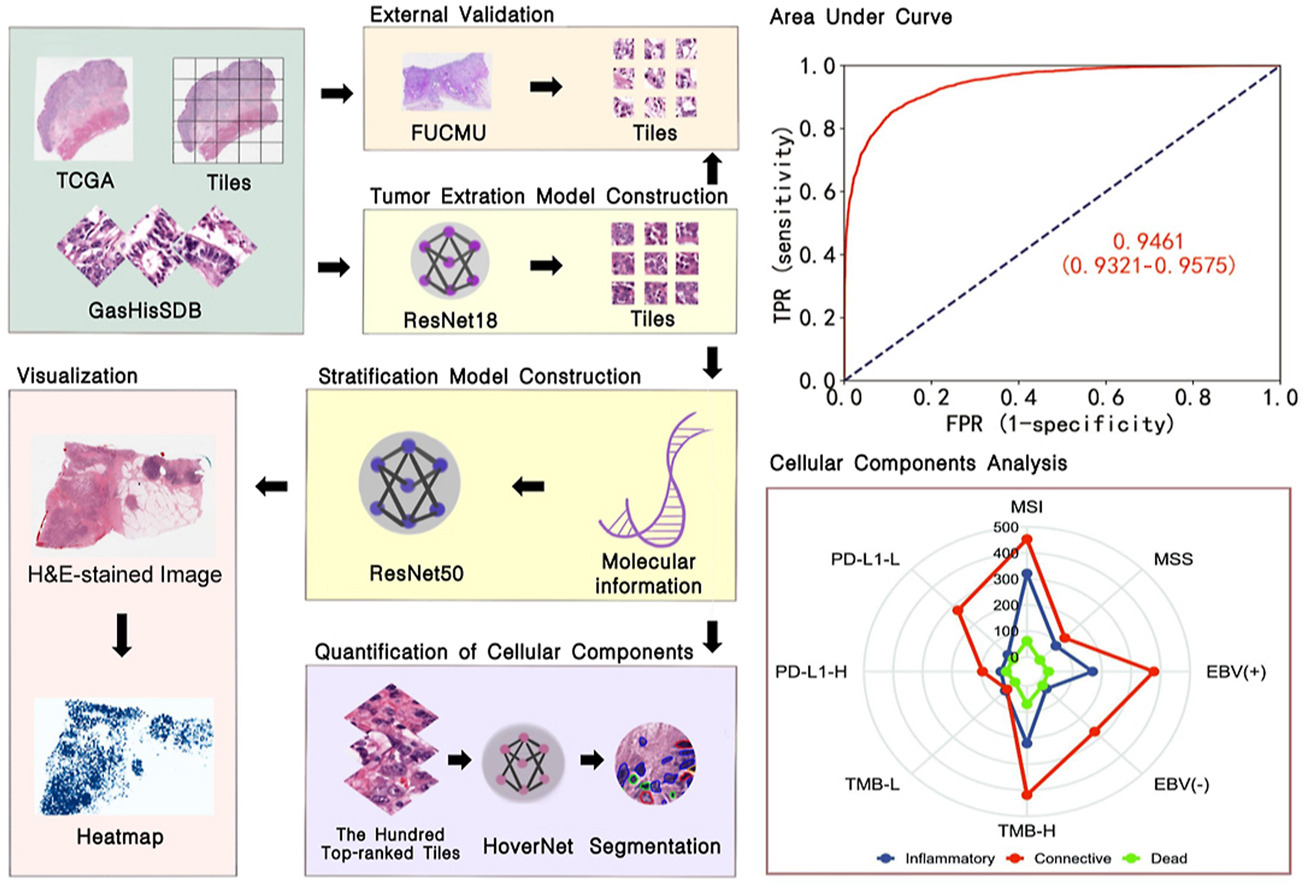
本文摘要图
研究人员通过基于深度学习模型预测血红素和血红蛋白染色图像的关键分子特征来筛选免疫治疗受益者。包括来自亚洲胃癌患者的独立数据集,以供外部验证。此外,还使用了分割模型(水平垂直网络)来量化肿瘤的细胞组成。通过测量曲线下的面积(AUC)来评估模型性能。
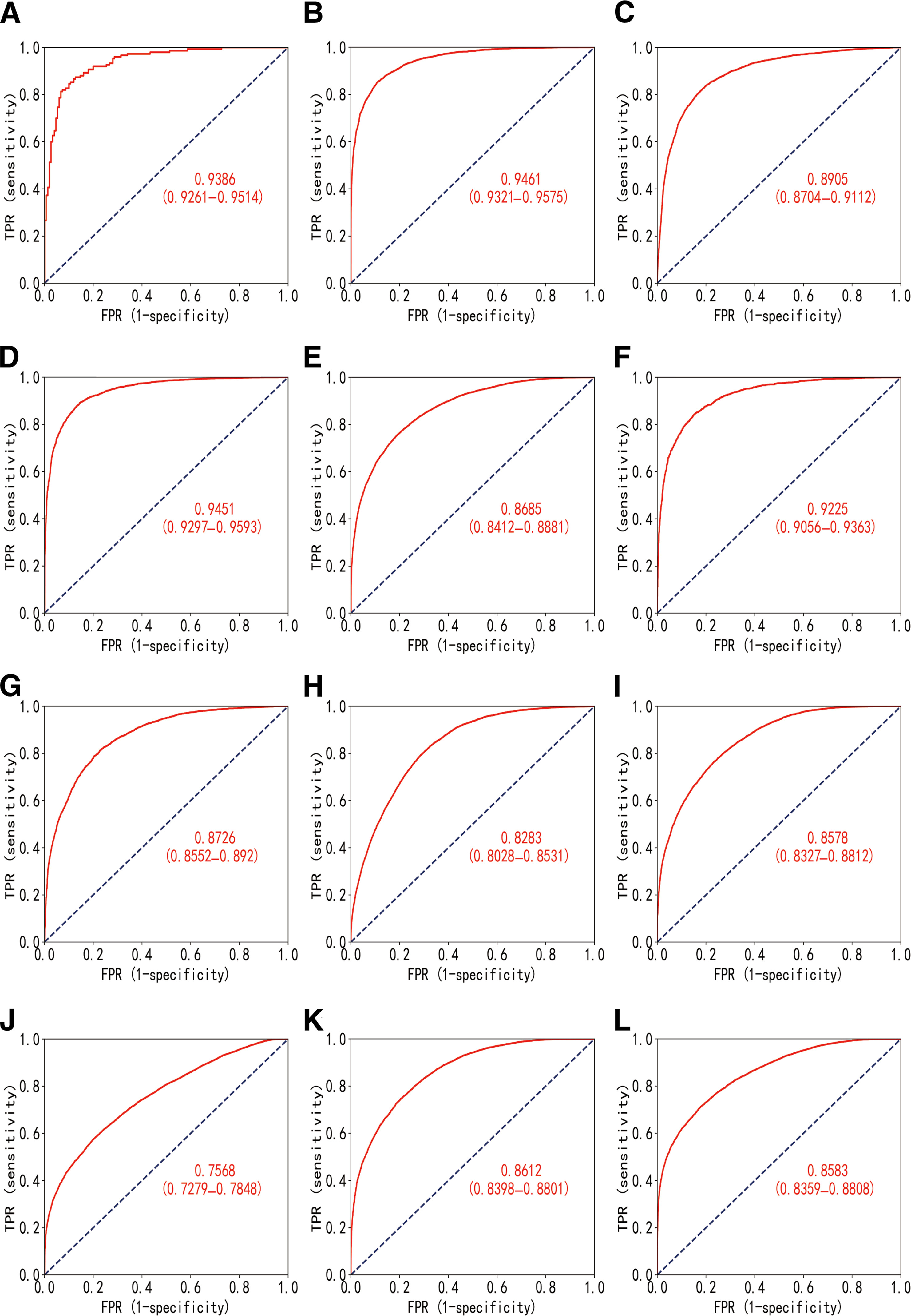
模型在肿瘤提取和患者分层方面的性能,以真阳性率(TPR)和假阳性率(FPR)为评估标准
研究结果显示,肿瘤提取模型在内部和外部测试集中的AUC分别为0.9386和0.9062。分层模型可以相当准确地预测免疫治疗敏感亚型(AUC范围,0.8685至0.9461)、基因突变(AUC范围,0.8283至0.9225)和通路活性(AUC范围,0.7568至0.8612)。在外部验证中,爱泼斯坦-巴尔病毒和程序性细胞死亡配体1表达状态的预测性能分别达到0.7906和0.6384的AUC。分割模型在一些免疫治疗敏感亚型中确定了相对较高比例的炎症细胞和结缔细胞。
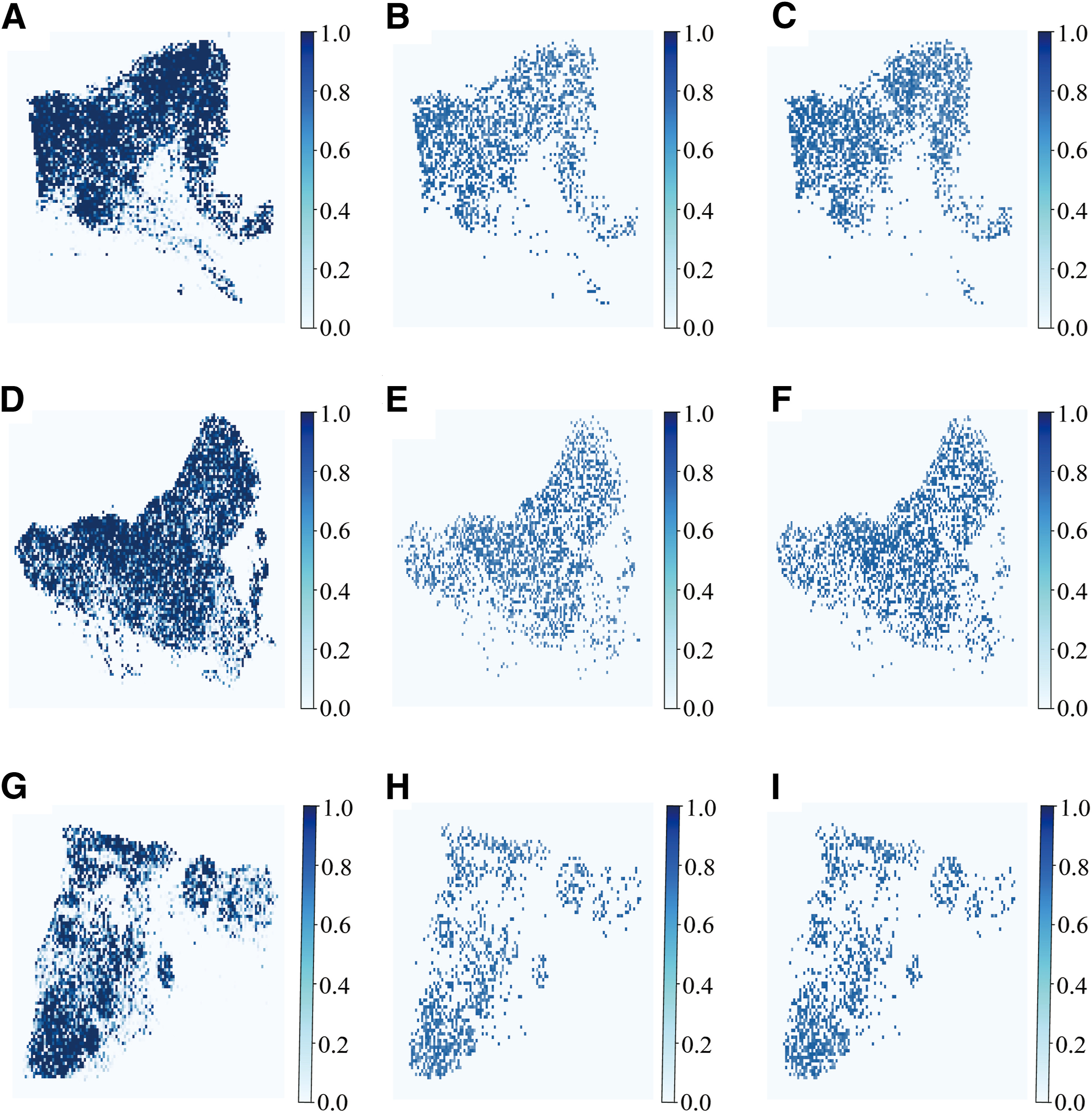
通过热图可视化来可视化深度学习模型
综上所述,与常规疗法相比,免疫疗法已被证明在临床实践中为晚期GC患者带来更好的预后。然而,最大限度地提高免疫治疗效果的患者分层策略尚未完全确定。目前的研究是首次,重点关注多种族患者,特别是GC发病率高的东亚人,使用DL方法彻底分析从H&E染色组织载玻片中提取的关键分子特征,这可以帮助分层GC患者从免疫治疗中获益。这种方法在促进分子分层方面非常有效,有助于选择有效的治疗并改善GC患者的临床预后。
原始出处
Wei Z, Zhao X, Chen J, Sun Q, Wang Z, Wang Y, Ye Z, Yuan Y, Sun L, Jing J. Deep Learning-Based Stratification of Gastric Cancer Patients from Hematoxylin and Eosin-Stained Whole Slide Images by Predicting Molecular Features for Immunotherapy Response. Am J Pathol. 2023 Oct;193(10):1517-1527. doi: 10.1016/j.ajpath.2023.06.004. Epub 2023 Jun 24.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言