Quant Imaging Med Surg:人工智能与放射科医生在基于计算机断层扫描图像的骨折检测的准确性分析
2023-11-14 医路坦克 MedSci原创 发表于上海
撕脱性骨折也是最常见的漏诊,延迟诊断导致更高的诉讼率。因此,本研究基于计算机断层扫描(CT)图像,评估优化前后人工智能(AI)模型的诊断效率,并与放射科医生的诊断效率进行比较,特别是对撕脱性骨折的诊断
据报道,外伤性骨折的发生率在美国高达0.32%,在中国高达1.3%,已成为全球关注的公共卫生问题。撕脱性骨折是指外伤后由于肌腱、韧带的牵拉导致骨碎片发生撕脱、移位,临床上很容易漏诊。Haraguchi等的研究表明,严重内翻损伤患者撕脱骨折的发生率较高,尤其是儿童和40岁以上患者。撕脱性骨折的诊断通常在数字摄影(DR)图像上是困难的。急诊的骨折X线片漏诊是医疗事故和诉讼的常见原因。
据报道,骨科医生的年诉讼率为14%,高于全国医生7%的平均水平。近年来,深度学习中的卷积神经网络(CNN)在各种非撕脱性骨折、韧带损伤和骨肿瘤分类的自动检测方面取得了显著的成果,包括上肢和下肢骨折[如桡骨远端、肱骨近端、髋粗隆间]、踝关节跟腓韧带损伤、骨盆和骶骨骨肉瘤分类。对于撕脱性骨折,骨折征象的影像学表现通常很难确定,因此很难获得足够数量的标记样本用于人工智能(AI)训练以提高其检测能力。

目前,深度学习在撕脱骨折中的应用研究较少。此外,大多数研究使用影像学报告或放射学专家对DR图像的解读作为评估参考,这可能受到个人经验的影响。因此,本研究使用计算机断层扫描(CT)图像验证X线片上的病变标记,然后优化用于检测四肢骨折的AI模型。评估优化前后AI模型的诊断效率,并与放射科医师进行比较,特别是在撕脱性骨折方面。
方法:回顾性收集我院2017 ~ 2020年成人肢体外伤的数字X线摄影[DR]和CT图像,伴有或不伴有1例及以上肩、肘、腕、手、髋、膝、踝、足骨折。骨折标记是指在相应的CT图像上显示骨折。对预优化的AI模型进行训练后,对预优化的AI、优化后的AI模型和初始放射学报告的诊断性能进行评估。在病变水平上,分析撕脱性骨折和非撕脱性骨折的检出率,在病例水平上,比较两者的准确性、敏感性和特异性。
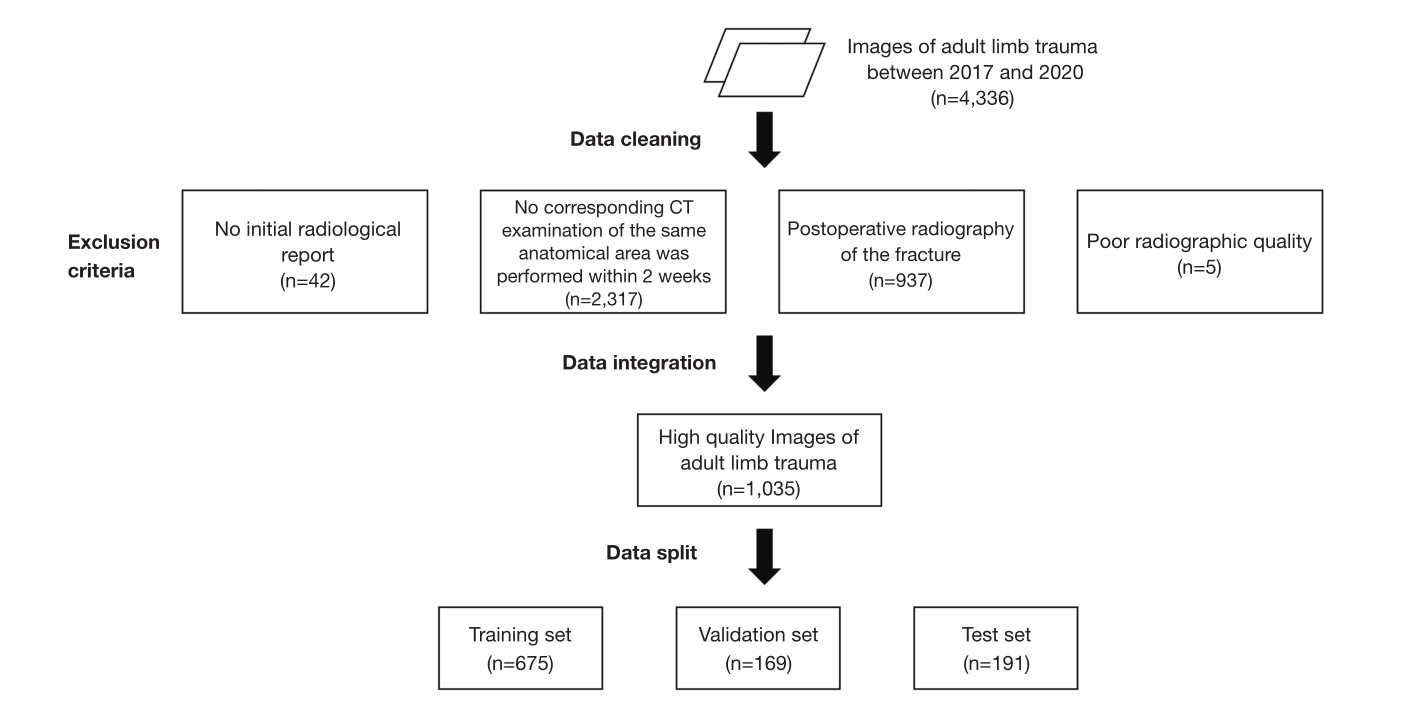
图1 骨折患者入组流程流程图。
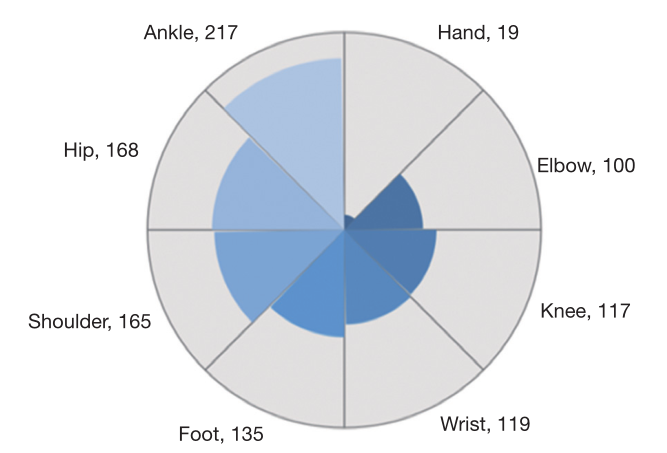
图2 总数据集中单个组件的数量
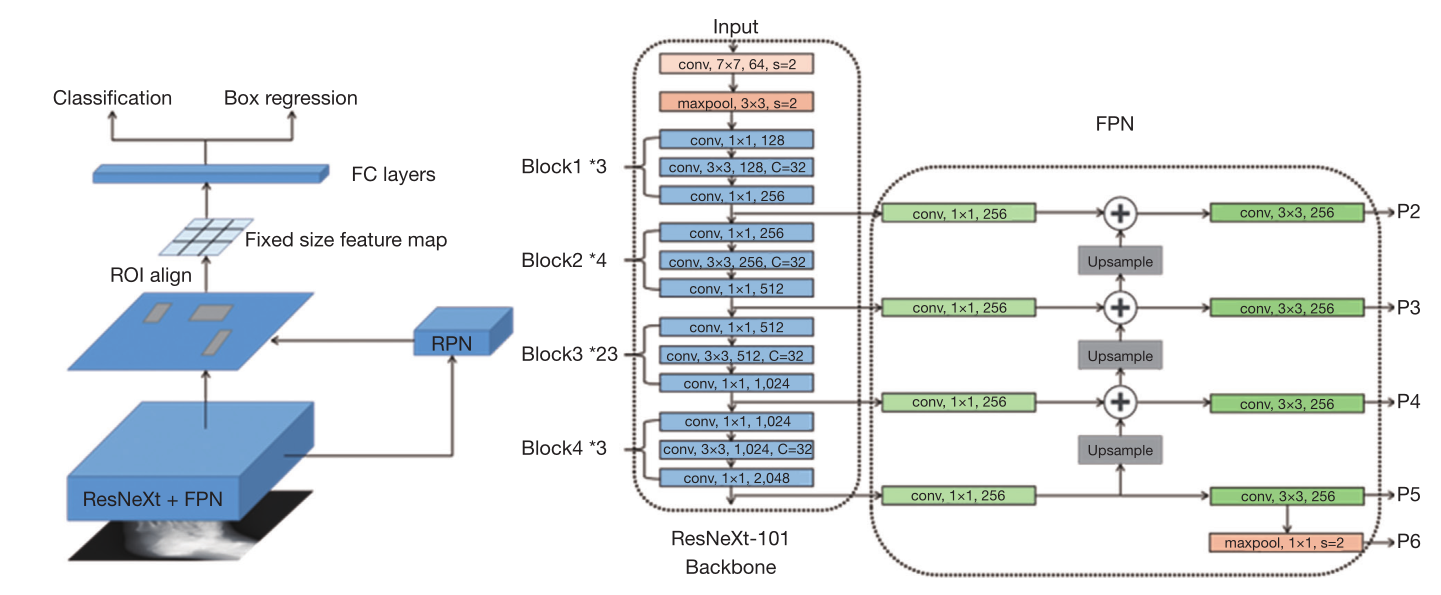
图3 本研究设计的主要算法流程图
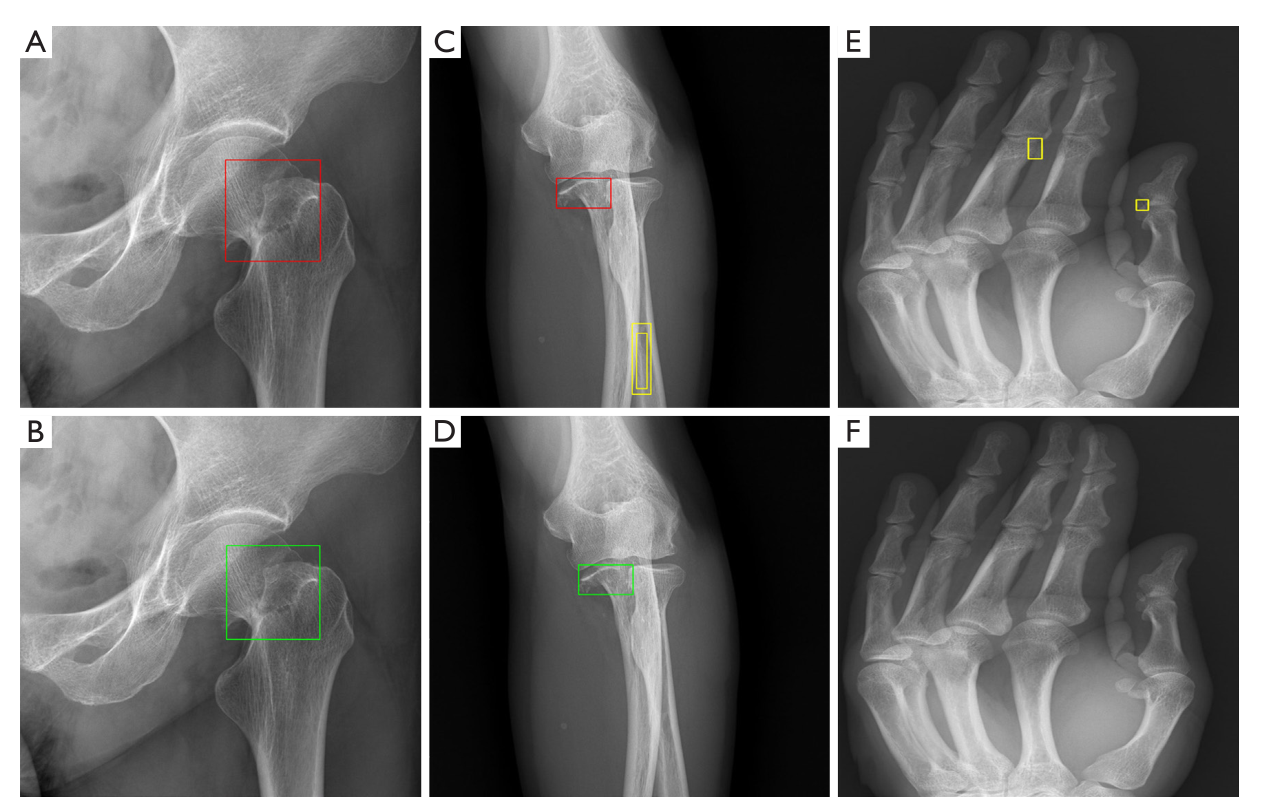
图4 预优化模型(A、C、E)和优化模型(B、D、F)股骨颈、尺骨和手部检测结果。
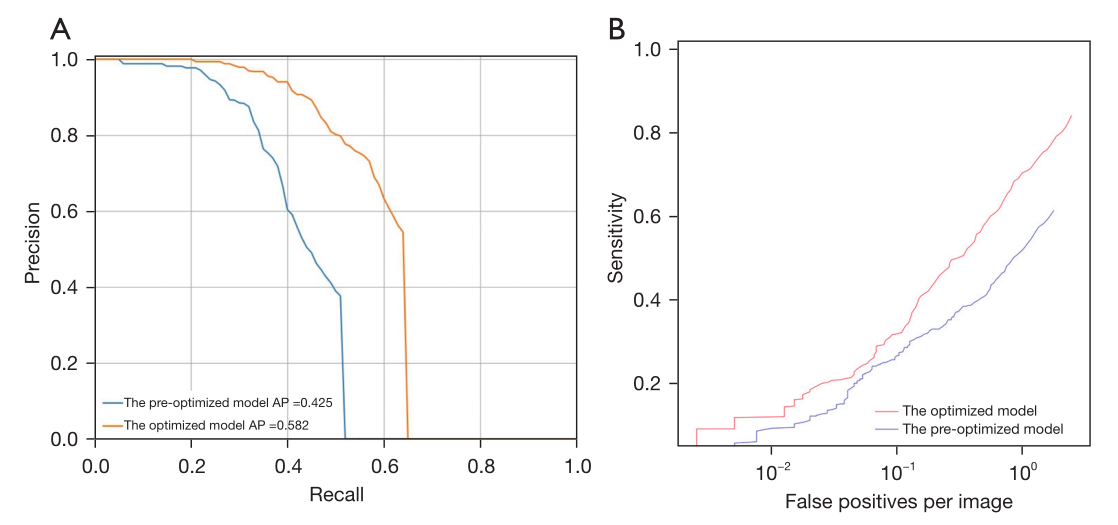
图5 预优化和优化AI模型病变水平分析时的PR曲线(A)和FROC曲线(B)
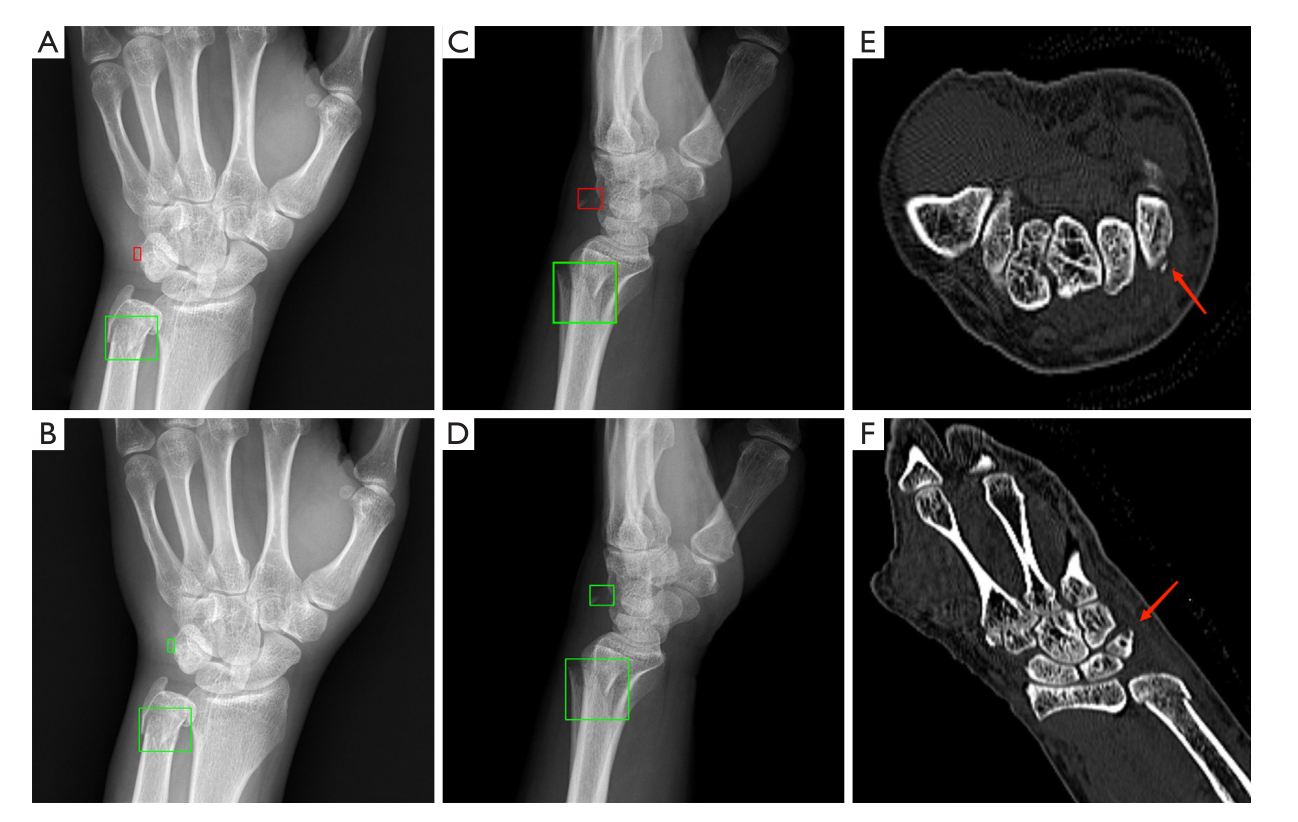
尺骨远端骨折合并三椎体撕脱骨折1例。最初的放射学报告(A和C,绿框)和优化后的模型(B和D,绿框)都正确识别了尺骨远端骨折。通过优化后的模型(B和D,绿框)检测出最初放射学报告中x线片上缺失的撕脱骨折(A和C,红框),相应的重建CT图像显示了撕脱骨折的碎片(E和F,箭头)。
结果:总数据集(1035例)分为训练集(n=675)、验证集(n=169)和测试集(n=191),呈平衡联合分布。在病变水平上,优化人工智能对撕脱性骨折(57.89% vs. 35.09%, P=0.004)和非撕脱性骨折(85.64% vs. 71.29%, P<0.001)的检出率显著高于预优化人工智能。优化后的AI模型对所有病变的平均精度(AP)均高于预先优化的AI模型(0.582 vs. 0.425)。优化后的AI模型对撕脱骨折的检出率明显高于放射科医师(57.89%比29.82%,P=0.002)。对于非撕脱性骨折,优化后的AI模型与放射科医师的检出率差异无统计学意义(P=0.853)。在病例水平上,优化后的人工智能模型准确率(86.40% vs. 71.93%, P<0.001)和灵敏度(87.29% vs. 73.48%, P<0.001)均显著高于预优化后的人工智能模型。优化后的AI模型与放射科医师的准确率、灵敏度、特异性比较,差异均无统计学意义(P < 0.05)。
结论:优化后的AI模型提高了X线片对四肢骨折的诊断效果,且优化后的AI模型对撕脱性骨折的诊断效果明显优于放射科医师,在骨科急诊的临床实践中可能有所帮助。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言