Genes & Diseases:Mo YY/Yang L/Peng WX教授团队揭示LINC00901促进胰腺癌发展
2024-05-07 Genes and Diseases Genes and Diseases 发表于上海
文章报道了长链非编码RNA(lncRNA) LINC00901在胰腺癌的发生、发展中起重要的促进作用,并受到m6A修饰调控。
N6-甲基腺苷(m6A)修饰是真核生物RNA中最常见和最丰富的修饰之一, 影响生物学过程的各个阶段,其失调可能导致包括癌症在内的多种疾病。胰腺导管腺癌 (PDAC) 是癌症相关死亡的第四大原因, 近年来的研究表明m6A的表观遗传调控在PDAC的发生中发挥了重要作用。然而,m6A修饰如何调控这一过程的机制尚不清楚。
来自浙江大学医学院儿童医院,杭州医学院人民医院和密西西比大学医学中心的Yin-Yuan Mo/Liu Yang/ Wan-Xin Peng 教授团队在本刊发表了题为“N6-methyladenosine modified LINC00901 promotes pancreatic cancer progression through IGF2BP2/MYC axis”的研究论文,报道了长链非编码RNA(lncRNA) LINC00901在胰腺癌的发生、发展中起重要的促进作用,并受到m6A修饰调控。
1. LINC00901被m6A修饰
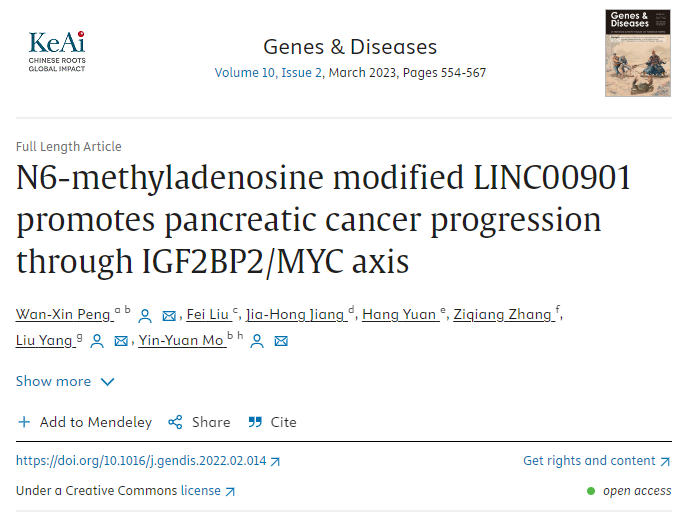
mRNA的m6A修饰在癌症等疾病中发挥着重要作用,然而人们对 lncRNA 的 m6A 修饰知之甚少。作者团队对人胰腺癌细胞(MIA PaCa-2)的RNA进行了甲基化RNA免疫共沉淀(meRIP)分析,发现一种被m6A修饰且富集的lncRNA——LINC00901 (图1A)。经过一系列实验,作者团队确认了LINC00901在PDAC中被m6A修饰(图1B–D),且可能在PDAC的发展中起关键作用。
2. LINC00901的表达水平增加与胰腺癌患者的不良预后相关
研究发现,PDAC患者中LINC00901的高表达与较低的总体生存率(OS)或无复发生存率(RFS)显著相关(图1E、F)。LncExpDB数据库的分析也揭示了与正常胰腺细胞相比,胰腺癌细胞系中LINC00901的表达明显增高。
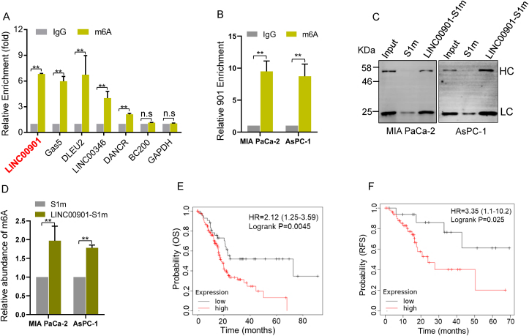
图1 LINC00901是一种m6A修饰的lncRNA,其高表达与PDAC患者的不良预后相关(原文中Figure 1)
3.LINC00901在PDAC中的致癌作用
通过在胰腺癌细胞中过表达LINC00901,作者团队发现LINC00901的过表达增加了细胞增殖和细胞生存,促进了细胞迁移和侵袭。此外,过表达LINC00901的小鼠移植瘤模型也表明,LINC00901显著促进了肿瘤的生长 (图2)。通过CRISPR/Cas9技术敲除LINC00901后,作者团队发现细胞增殖率显著降低,细胞存活能力被抑制,迁移和侵袭能力也明显受损。
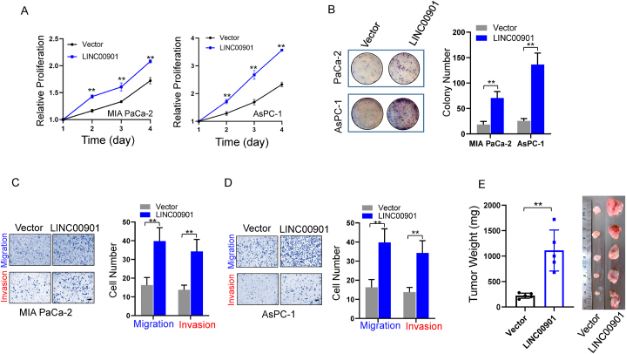
图2 LINC00901过表达对PDAC细胞增殖、侵袭和肿瘤生长的影响 (原文中Figure 2)
4.YTHDF1作为阅读蛋白对LINC00901的m6A修饰进行调控,并使LINC00901下调
YTH 家族蛋白是主要的 m6A 读码器。作者团队的研究发现,YTHDF1是其中唯一能与LINC00901相互作用的蛋白 (图3A–C)。如果过表达YTHDF1,LINC00901的水平会下降(图3D),而如果敲除YTHDF1,LINC00901的水平会显著增高(图3E)。这些结果表明,YTHDF1是LINC00901的负向调节因子。
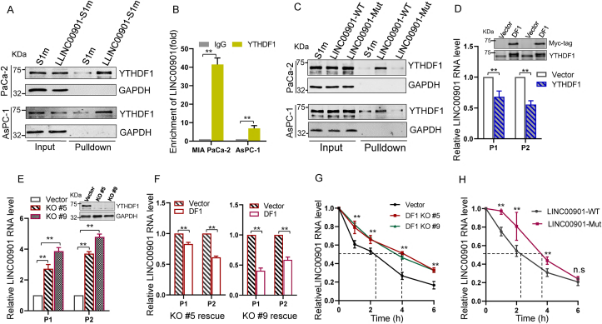
图3 YTHDF1抑制m6A 修饰的LINC00901的表达(原文中Figure 4)
5.LINC00901对MYC表达的影响
RNA测序显示,LINC00901的水平与MAPK信号通路正相关,且可以影响MYC基因(图4A–C)。进一步分析发现,LINC00901的过表达或敲除均能显著影响MYC及其靶基因CDK4、CDC20、MCM2、MMP3和SNAI2的表达(图4D、E)。
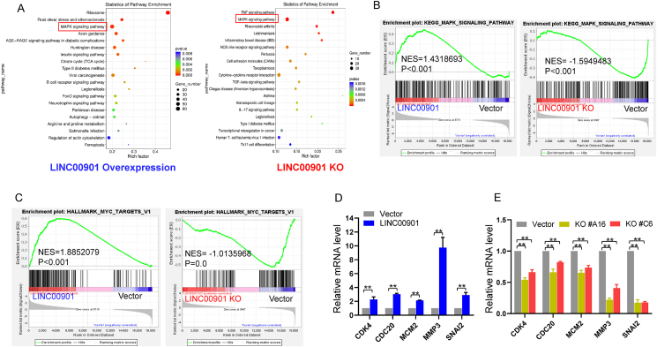
图4 LINC00901 调节 MYC 信号通路 (原文中Figure 5)
总之,本研究揭示LINC00901在PDAC发展中的关键作用。LINC00901受N6-甲基腺苷(m6A)修饰,其过表达后能促进PDAC细胞的增殖、迁移和侵袭。m6A阅读蛋白YTHDF1影响LINC00901的表达水平,进一步调控MYC基因,并影响其靶基因的表达。这一发现暗示了LINC00901作为PDAC潜在治疗靶点的可能性。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304222000708
引用这篇文章:
Peng WX, Liu F, Jiang JH, et al. N6-methyladenosine modified LINC00901 promotes pancreatic cancer progression through IGF2BP2/MYC axis. Genes Dis. 2023;10(2):554-567.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胰腺癌# #LINC00901#
11