前列腺癌钙信号机制及靶向药物总结!
2024-05-19 梅斯肿瘤新前沿 MedSci原创 发表于上海
前列腺癌是全球男性最常见的恶性肿瘤之一,严重威胁男性的健康。钙离子信号通路在前列腺癌的发生和发展中扮演着关键角色。这一通路包括多种钙离子通道、转运体和效应分子,它们共同调控细胞内的钙离子水平。

引言
前列腺癌是全球男性最常见的恶性肿瘤之一,严重威胁男性的健康。钙离子信号通路在前列腺癌的发生和发展中扮演着关键角色。这一通路包括多种钙离子通道、转运体和效应分子,它们共同调控细胞内的钙离子水平。研究发现,前列腺癌细胞会改变钙离子信号通路相关基因的表达,进而影响钙离子信号的调控,促进癌细胞的生存、增殖、迁移、侵袭以及对抗治疗的耐药性。因此,靶向调控钙离子信号通路有望为前列腺癌的治疗提供新的策略。目前,已有多款靶向钙离子信号通路的药物进入临床试验阶段,如mipsagargin、mibefradil、SOR-C13、tranilast等。这些药物具有选择性调控钙离子信号通路的潜力,展现出作为前列腺癌治疗新手段的潜力。未来,进一步研究钙离子信号通路在前列腺癌中的作用机制,以及开发更多靶向药物,有望为前列腺癌患者带来新的治疗希望。
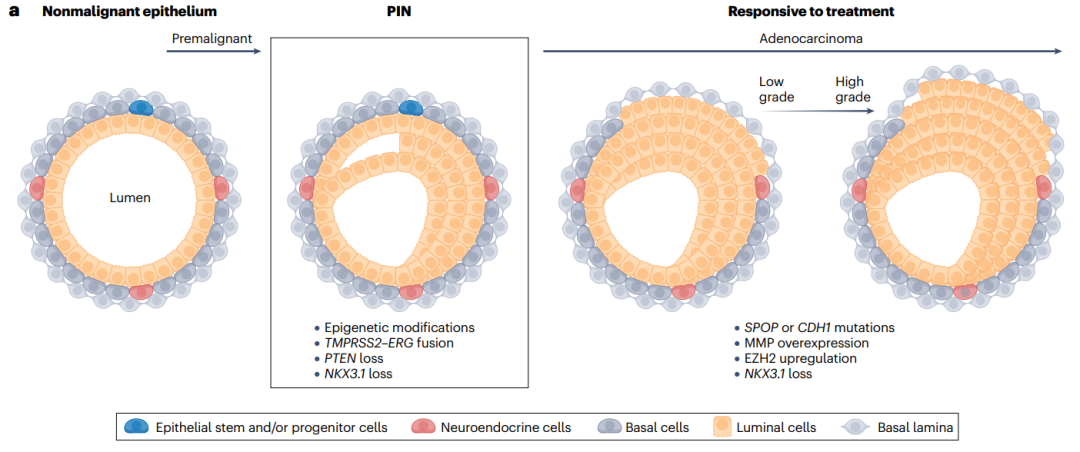
Figure1a前列腺癌从癌前病变的前列腺上皮内瘤变(PIN)到早期腺癌的演变。
正常上皮组织:
-
特点:由表皮干细胞或祖细胞、神经内分泌细胞、基底细胞和腔细胞组成,具有清晰的基底层和上皮层结构。
-
标记:蓝色代表表皮干细胞或祖细胞,粉色代表神经内分泌细胞,灰色代表基底细胞,橙色代表腔细胞。
PIN(前列腺上皮内瘤变):
-
特点:上皮细胞排列紊乱,基底层和上皮层界限模糊。
-
标记:除正常颜色外,还出现红色和白色标记,可能代表异常细胞或炎症反应。
-
分子改变:包括表观遗传修饰、TMRSS2-ERG融合、PTEN丢失和NKX3.1丢失。
治疗响应的上皮组织:
-
分类:分为低级别和高级别两种亚型。
-
特点:高级别亚型显示更严重的恶性特征,如SPOP或CDH1突变、MMP过表达、EZH2上调和NKX3.1丢失。
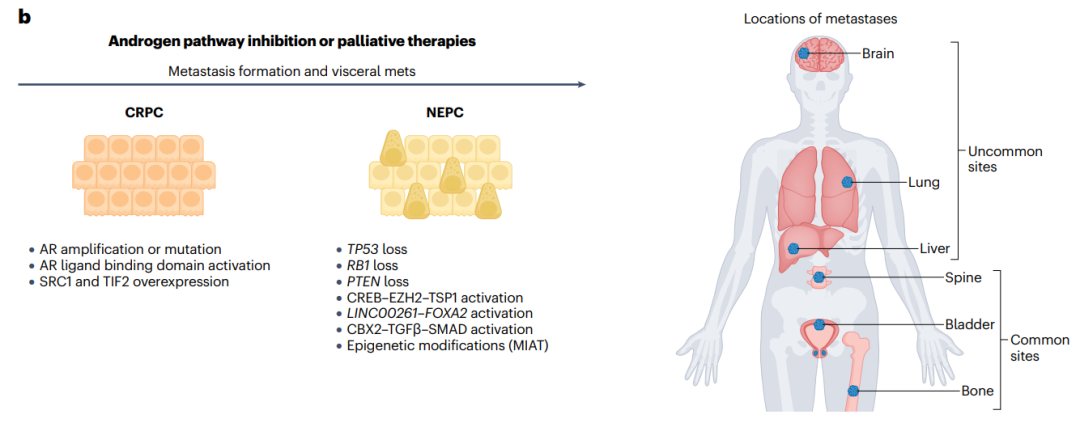
Figure1b去势抵抗性前列腺癌(CRPC)最先进的形态和神经内分泌前列腺癌(NEPC),以及常见的和罕见的转移部位。
前列腺癌细胞可以通过多种逃逸机制获得对ADT(雄激素剥夺治疗)的抵抗力,从而通过替代途径激活AR(雄激素受体)信号轴:
-
AR的扩增或突变;AR配体结合域的缺失;AR共激活剂SRC1和TIF2的过表达;以及通过糖皮质激素受体非典型激活AR信号通路。
-
CRPC(去势抵抗性前列腺癌)仍然依赖AR信号通路的激活;因此,研究正在进行中,以开发新的AR靶向策略,这可能会改善患者的预后。然而,这些AR靶向策略对AR独立型前列腺癌细胞,如NEPC(神经内分泌前列腺癌)无效。
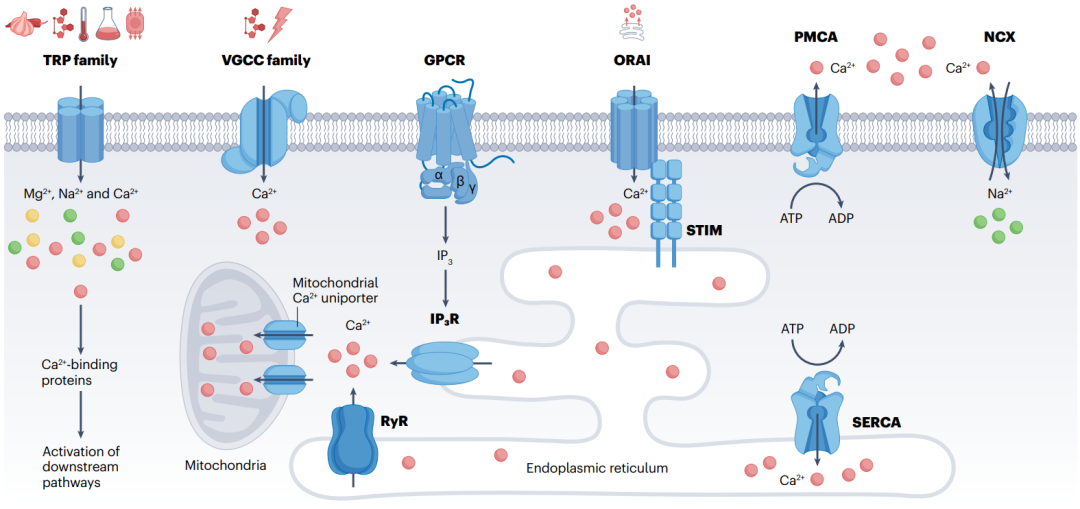

Figure2
图 2 | 钙信号传递工具包的组成部分。
图中展示了部分最广泛表达的钙信号传递工具包组件,包括属于瞬时受体电位(TRP)超家族的质膜钙通道、电压门控钙通道(VGCC)家族和ORAI。
-
对于这些通道,主要的激活刺激包括:TRP通道的细胞代谢物、温度、酸和机械力;VGCC通道的细胞代谢物和膜电位;以及对于参与通过钙库操纵钙内流(SOCE)的ORAIs,其激活刺激为钙库耗竭。
-
质膜上的其他钙信号传递组件包括质膜钙-ATP酶(PMCA)和Na+/Ca2+交换器(NCX),它们对于维持细胞质钙浓度以及在信号传递过程中从细胞质钙增加中恢复至关重要;以及G蛋白偶联受体(GPCR),其介导内质网膜上镶嵌的肌醇1,4,5-三磷酸受体的激活。
-
Ryanodine受体(RyR)和IP3Rs能够增强由TRP和VGCCs产生的钙信号,促进钙通过线粒体钙单向转运体流入线粒体,并导致钙库耗竭,这一耗竭被stromal interaction molecule(STIM)感知,随后激活SOCE(通过ORAIs通道)。
-
肌质网内质网钙-ATP酶(SERCA)将钙从细胞质转运到肌质内质网,是补充细胞内储存的关键。
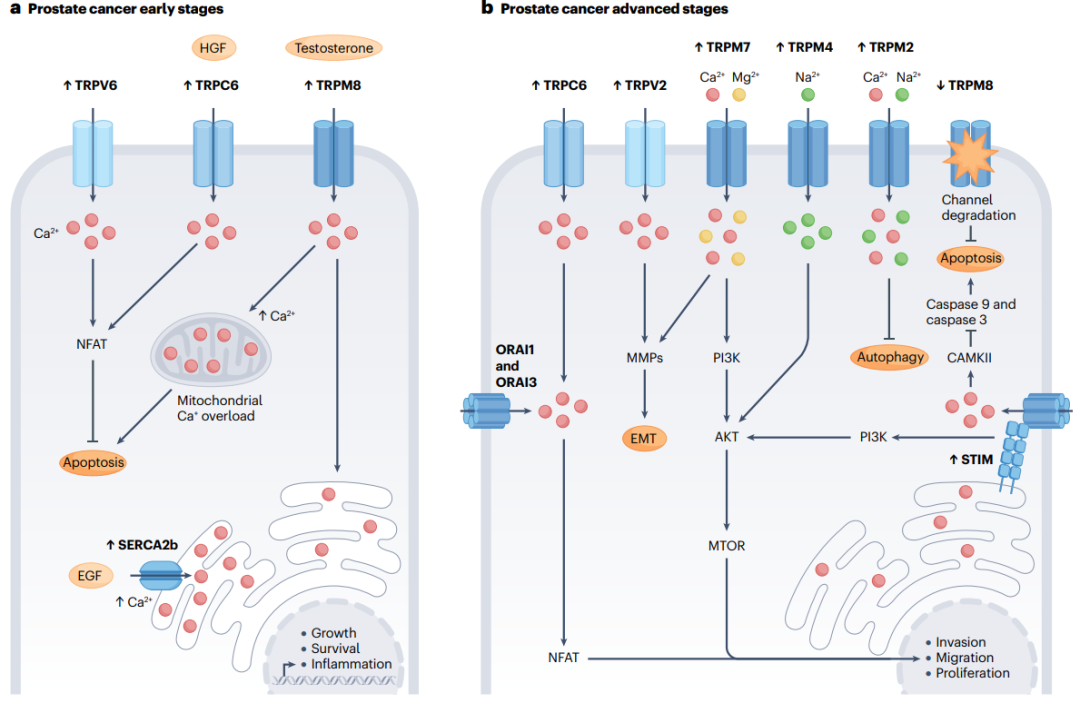
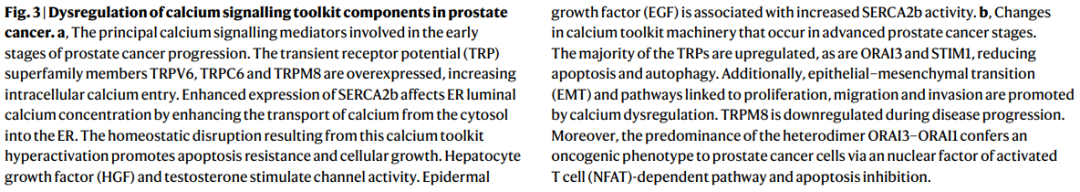
Figure3前列腺癌中钙信号传递工具包组件的失调。
a, 在前列腺癌进展的早期阶段涉及的主要钙信号传递介质。瞬时受体电位(TRP)超家族成员TRPV6、TRPC6和TRPM8过度表达,增加了细胞内钙的进入。SERCA2b表达增强通过促进钙从细胞质转运到内质网,影响内质网腔内钙浓度。由此产生的钙工具包过度激活导致内环境稳态破坏,进而促进凋亡抵抗和细胞生长。肝细胞生长因子(HGF)和睾酮刺激通道活性。表皮生长因子(EGF)与SERCA2b活性增加有关。
b, 在晚期前列腺癌阶段钙工具包机制的变化。大多数TRP通道上调,ORAI3和STIM1也上调,减少了凋亡和自噬。此外,钙失调还促进了上皮-间质转化(EMT)以及与增殖、迁移和侵袭相关的途径。TRPM8在疾病进展过程中下调。此外,异二聚体ORAI3-ORAI1的优先存在通过核因子激活的T细胞(NFAT)依赖途径赋予前列腺癌细胞癌基因表型,并抑制凋亡。
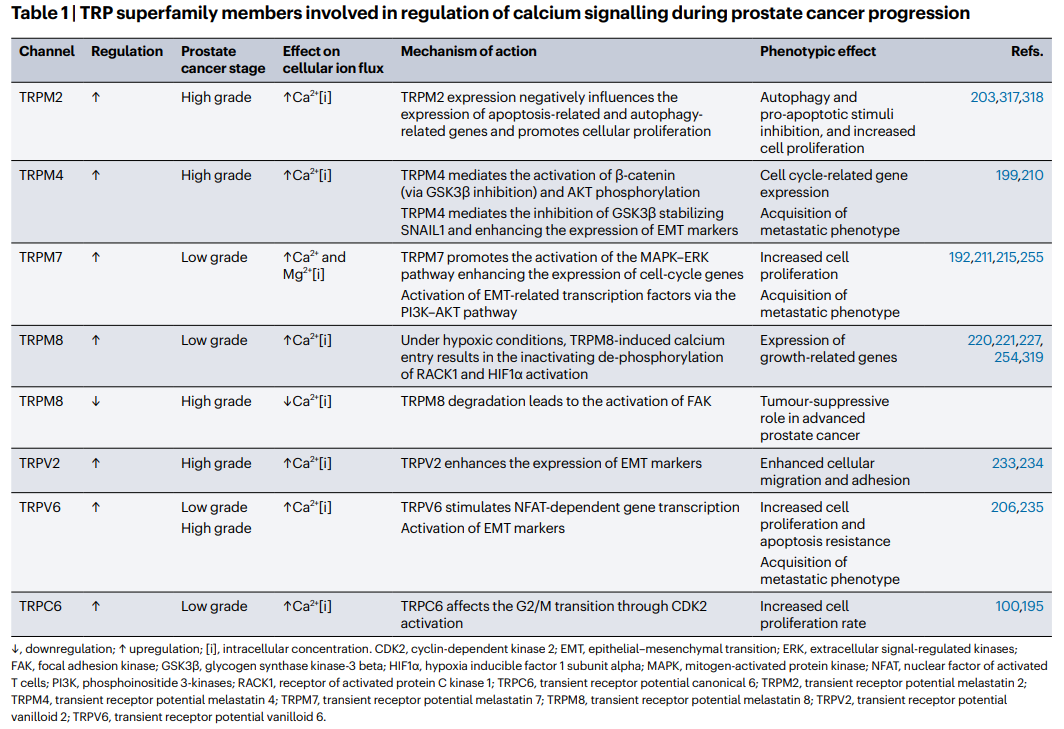
Table1表格展示了与前列腺癌进展中的钙信号调节相关的TRP超家族成员。
它包括每个成员的通道、调控方式、在前列腺癌阶段的影响、对细胞离子流的影响、作用机制以及表型效应。这些成员分别是:TRPM2、TRPM4、TRPM7、TRPM8、TRPV2、TRPV6、TRPC6。
-
TRPM2在高级别前列腺癌细胞中表达上调,增加细胞内钙离子浓度。它的表达抑制凋亡相关和自噬相关的基因表达,促进细胞增殖,并通过自噬和抗凋亡刺激物的抑制以及细胞的增殖来发挥表型效应。
-
TRPM4也在高级别前列腺癌细胞中表达上调,同样增加细胞内钙离子浓度。它通过GSK3β抑制激活β-catenin,并通过AKT磷酸化稳定SNAIL1,从而增强EMT标记物的表达。这导致了细胞周期相关基因的表达和获得转移表型。
-
TRPM7在低级别的前列腺癌中表达增加,导致钙离子和镁离子的增加。它的作用机制是通过激活MAPK-ERK通路来增强细胞周期基因的表达,并通过PI3K-AKT通路激活EMT相关的转录因子。其表型效应是增加细胞增殖和获得转移表型。
-
TRPM8在缺氧条件下,在高级别的前列腺癌中表达增加,导致钙离子的增加。它的作用机制是在进入钙离子后失活RACK1和HIF1α。其表型效应是表达生长相关基因。
-
TRPM8降解导致高级别前列腺癌中FAK的激活,具有肿瘤抑制作用。
-
TRPV2在高级别的前列腺癌中表达增加,导致钙离子的增加。它的作用机制是增强EMT标记物的表达。其表型效应是增强细胞迁移和粘附。
-
TRPV6在低级别和高级别的前列腺癌中表达增加,导致钙离子的增加。它的作用机制是刺激NFAT依赖的基因转录和激活EMT标记物。其表型效应是增加细胞增殖和凋亡抵抗,并获得转移表型。
-
TRPC6在低级别前列腺癌中表达,通过CDK2激活影响G2/M转换,增加细胞增殖率。
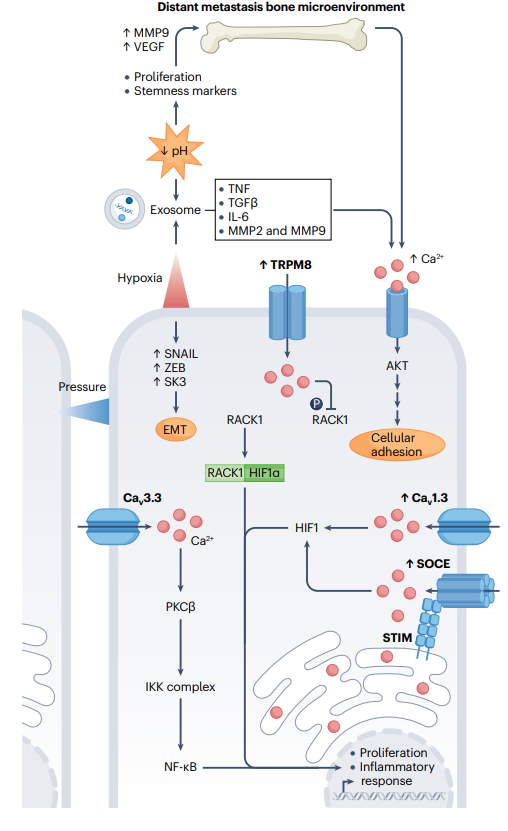
Figure4 参与骨转移的钙信号传递工具包组件。
在前列腺癌转移过程中,主要的钙信号传递介质及其相关途径涉及骨归巢。缺氧、压力和细胞pH的改变是主要影响肿瘤微环境并促进钙进入的刺激因素。
-
特别是,缺氧环境导致细胞内钙增加,这一过程受到TRPM8和Cav1.3过表达的支持,以及SOCE的激活。这些事件导致缺氧诱导因子-α(HIF1α)的表达,促进缺氧适应性基因的转录。
-
缺氧通过诱导干细胞标记物的产生,包括SNAIL、ZEB和SK3,这些标记物驱动上皮-间质转化(EMT),从而促进肿瘤细胞的侵袭性。
-
此外,缺氧刺激的外泌体生产和酸性细胞外pH似乎在远处预处理生态位的形成中具有关键作用,因为它们富含基质金属蛋白酶(MMPs)、生长因子和细胞因子。这些事件由于生长肿瘤的压力而进一步加剧。
-
压力通过包括Cav3.3在内的通道增加细胞内钙,驱动PKCβ–IKK–IκB–NF-κB途径,刺激癌细胞增殖并创建支持肿瘤生长的正反馈循环。
-
此外,酸性肿瘤微环境可能具有通过增强干细胞标记物(如CD133、CD44、OCT4和KLF4)、细胞侵袭性和增殖以及VEGF诱导的血管生成来调节前列腺癌远处转移的潜力。
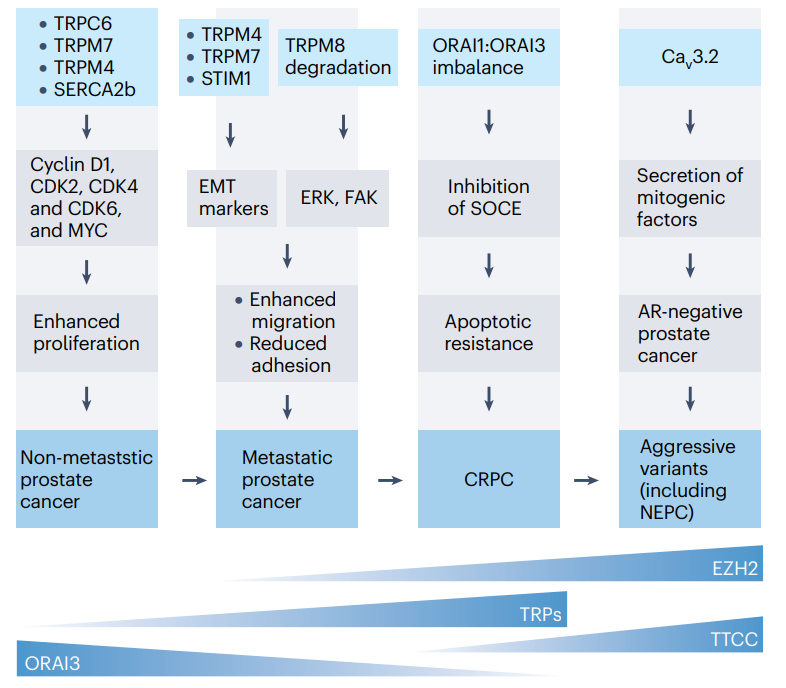

Figure 5 | 前列腺癌中钙信号改变的统一模型。
钙在前列腺癌中的作用仍需要进一步的特征描述,但当前的证据强调了钙信号与前列腺癌发生、进展和侵略性之间不可否认的联系。
-
SERCA2b ATPase190和许多TRP通道,包括TRPC6、TRPM2、TRPM4、TRPM7和TRPV6,在前列腺癌早期阶段会上调。
-
在向晚期前列腺癌进展的过程中,TRPM4、TRPM7、TRPV2和TRPV6以及STIM1的上调有助于获得转移表型。
-
TWIST、SNAIL和ZEB的稳定化导致编码MMPs、N-钙粘蛋白和组织蛋白酶B的基因转录激活,从而引起EMT(上皮-间质转化)和前列腺癌细胞从原发部位逃逸。此外,TRPM8在前列腺癌晚期阶段的丧失也有利于转移表型,因为TRPM8抑制对细胞迁移至关重要的ERK和FAK。
-
在向去势抵抗型转变的过程中,前列腺癌细胞对凋亡刺激的抵抗力逐渐增强。这一事件中的主要钙信号传递介质是ORAI1和ORAI3。
-
不同的证据表明TTCCs(T型电压门控钙通道)参与了前列腺癌细胞中NED(神经内分泌分化)特征的形态和生化变化。特别是,前列腺癌细胞中TTCCs表达的增加刺激了神经样过程的发育,这是在经历NED的细胞中观察到的形态分化的典型特征。
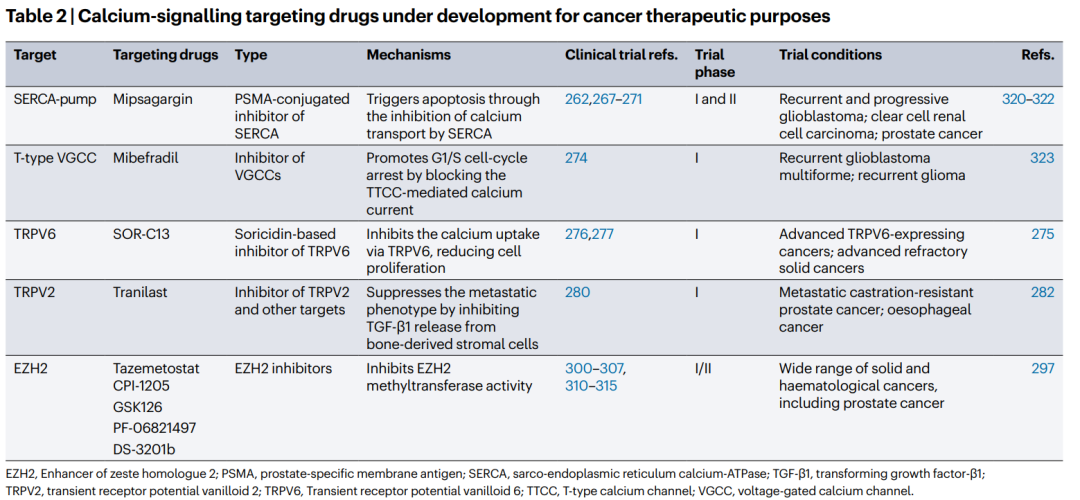
Table2 用于癌症治疗目的的正在开发的钙信号靶向药物
Mipsagargin(米沙加辛)
-
属于SERCA泵。
-
类型:PSMA偶联抑制剂of SERCA。
-
机制:通过抑制SERCA的钙转运触发凋亡。
-
试验阶段:I和II期。
-
试验条件:复发性胶质母细胞瘤;透明细胞肾细胞癌;前列腺癌。
Mibefradil(米贝拉地尔) -
-
目标:T型VGCC。
-
类型:VGCC抑制剂。
-
机制:通过阻断TTCC介导的钙电流促进G1/S细胞周期阻滞。
-
试验阶段:I期。
-
试验条件:复发性胶质母细胞瘤多形性;复发性胶质瘤。
SOR-C13
-
目标:TRPV6。
-
类型:基于索利迪定的TRPV6抑制剂。
-
机制:通过TRPV6抑制钙摄取,从而减少细胞增殖。临床试验参考:276, 277。
-
试验阶段:I期。
-
试验条件:晚期TRPV6表达的癌症;晚期难治性实体瘤。
Tralast(曲拉司他)
-
目标:TRPV2和其他靶点。
-
类型:TRPV2抑制剂。
-
机制:通过抑制骨源性基质细胞释放TGF-β1来抑制转移表型。
-
试验阶段:I期。
-
试验条件:转移性去势抵抗性前列腺癌;食道癌。
EZH2抑制剂
-
包括Tazemetostat(塔扎莫司)、CPI-1205、GSK126、PF-06821497和DS-3201b等。
-
类型:EZH2抑制剂。
-
机制:通过抑制EZH2甲基转移酶活性发挥作用。
-
试验阶段:I/II期。
-
试验条件:广泛的实体瘤和血液系统恶性肿瘤,包括前列腺癌。
参考文献:
Silvestri et al. Calcium signalling pathways in prostate cancer initiation and progression. Nat Rev Urol. 2023 Sep;20(9):524-543.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#前列腺癌# #钙信号#
7