PNAS:CD4+ T 细胞中的 IL-6/gp130 信号传导驱动肺动脉高压的发病机制
2024-04-25 刘少飞 MedSci原创 发表于上海
CD4+细胞中的IL-6/gp130信号通路在肺动脉高压的病理生理中扮演着关键的角色,IL-6缺陷对治疗PAH具有潜在的改善作用,为未来开发更有效的治疗策略提供了新的方向。
 研究背景:
研究背景:
肺动脉高压(PAH)是一种罕见但危及生命的心血管疾病,其特征是肺血管的狭窄和阻塞,导致肺动脉压力升高和右心衰竭。近年来,越来越多的研究表明,白细胞介素(IL)-6在PAH的发病机制中发挥着重要作用,但其具体靶细胞尚未完全理解。
研究目的: 本研究的目的是通过探索IL-6/gp130信号通路在CD4+细胞中的作用,揭示其在PAH病理生理中的关键作用,并探索IL-6在严重PAH模型中的治疗潜力。
研究方法:
研究团队使用了携带gp130 floxed等位基因的小鼠模型,并通过CRISPR/Cas9系统开发了Il6敲除(KO)大鼠模型。通过各种分子生物学和病理学技术对小鼠和大鼠模型进行了详细的分析,以评估IL-6/gp130信号通路在PAH病理生理中的作用。
研究结果:
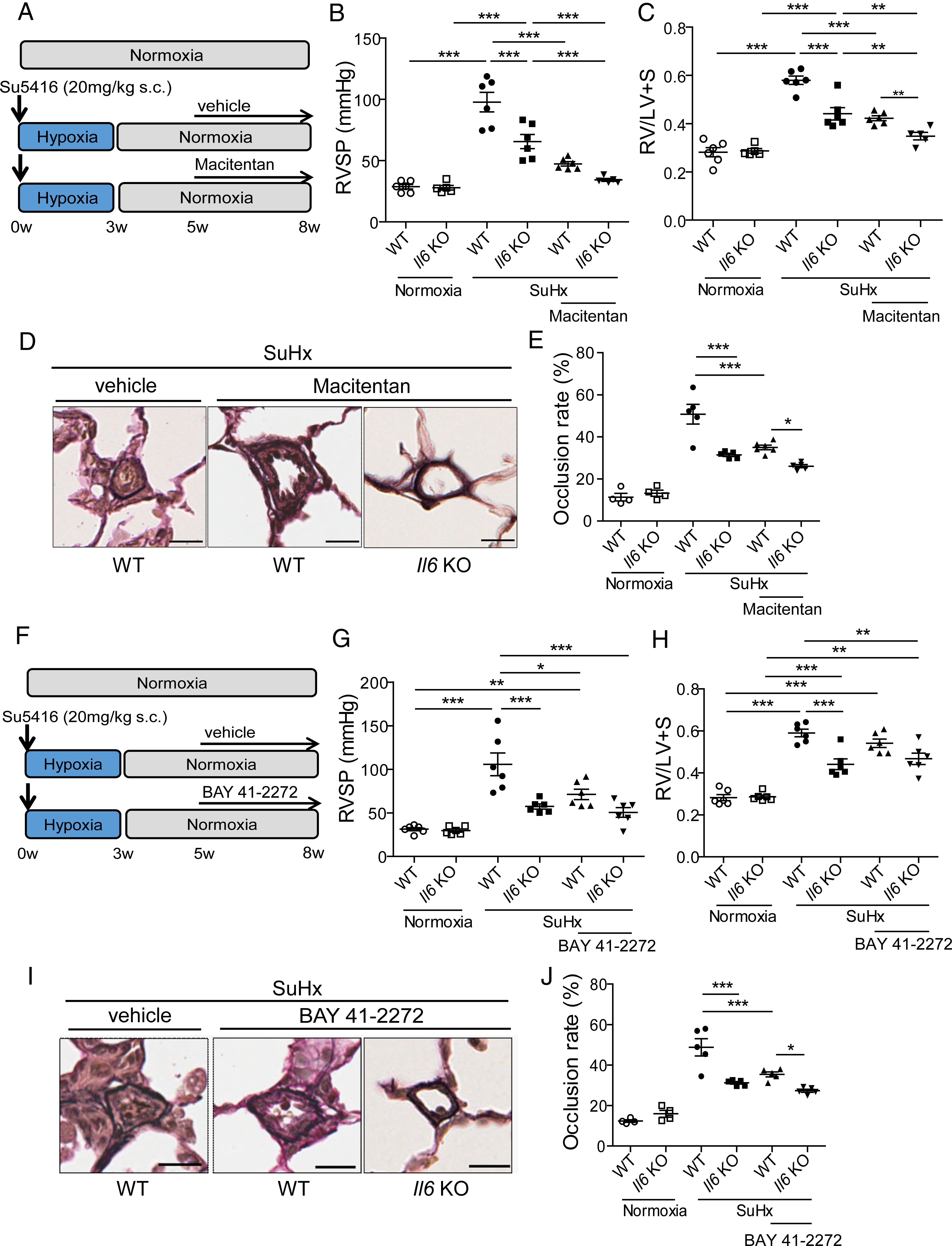
实验结果显示,CD4+细胞中的IL-6/gp130信号通路在PAH的发病机制中起着关键作用。通过gp130缺陷和IL-6缺陷的实验,研究团队发现,IL-6/gp130信号通路缺陷可以显著改善小鼠和大鼠的PAH表型,并且与常规PAH治疗方法的联合应用效果显著。
研究结论:
该研究揭示了CD4+细胞中的IL-6/gp130信号通路在PAH病理生理中的重要作用,并证实了IL-6缺陷对PAH的治疗潜力。这一发现为未来开发更有效的PAH治疗策略提供了新的思路,并有望为个性化治疗提供更好的选择。
展望: 下一步,研究团队将进一步探索IL-6/gp130信号通路在其他类型的PAH模型中的作用,并研究IL-6信号通路调节剂在临床治疗中的应用前景。这一研究成果有望为PAH患者带来更有效的治疗方案,并为心血管疾病的治疗开辟新的途径。
参考文献:
Ishibashi T, Inagaki T, Okazawa M, Yamagishi A, Ohta-Ogo K, Asano R, Masaki T, Kotani Y, Ding X, Chikaishi-Kirino T, Maedera N, Shirai M, Hatakeyama K, Kubota Y, Kishimoto T, Nakaoka Y. IL-6/gp130 signaling in CD4+ T cells drives the pathogenesis of pulmonary hypertension. Proc Natl Acad Sci U S A. 2024 Apr 16;121(16):e2315123121. doi: 10.1073/pnas.2315123121. Epub 2024 Apr 11. PMID: 38602915.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肺动脉高压# #CD4+ T 细胞# # IL-6/gp130 信号#
7
好文章,谢谢分享。
0