Haematologica:BCMA CAR-T治疗伴肾损害RRMM的首个大型回顾性研究
2023-10-01 聊聊血液 聊聊血液 发表于陕西省
研究旨在评价接受标准治疗 (SOC) ide-cel 治疗的伴RI 的 RRMM 患者的真实世界结局。
CAR-T治疗肾损害RRMM
Idecabtagene vicleucel (ide-cel)是一种自体BCMA CAR-T细胞治疗产品,可用于既往≥4线治疗的复发难治性多发性骨髓瘤(RRMM)患者。但其关键研究排除了筛选时伴肾损害(RI,肌酐清除率[CrCl]< 45mL/min)的患者,其他CAR-T的研究也相似。
由于管型肾病,约20%的MM患者诊断时存在RI,尽管无法获得复发患者的确切估计值,但部分患者在诊断后肾功能未恢复,或在治疗过程中或由于疾病复发而发生肾功能受损,从而限制了CAR-T在相当大比例的肾功能受损患者中的应用。
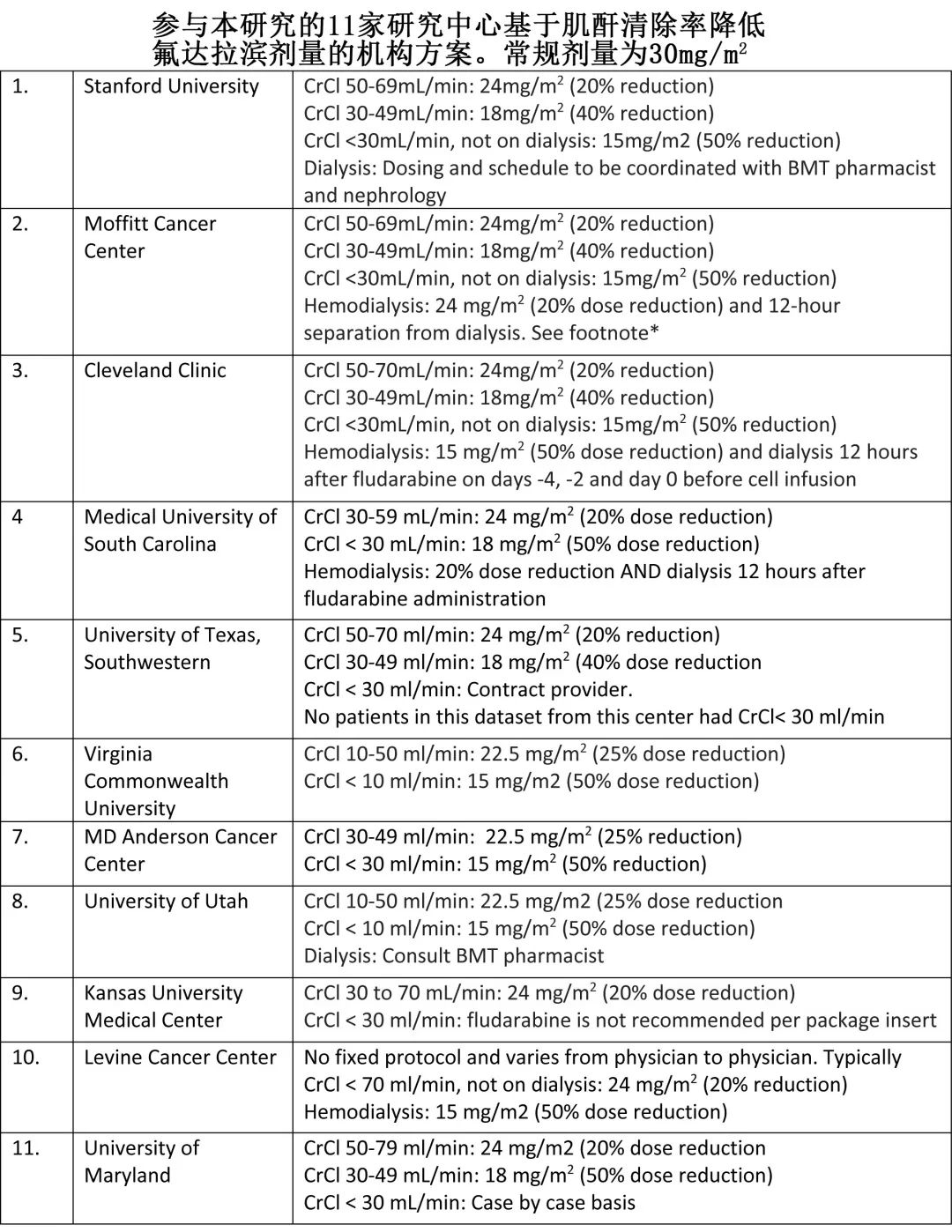
RI 患者使用 CAR-T 细胞治疗主要有两个问题。首先是缺乏 CAR-T 细胞在该患者人群中的安全性和疗效数据,其次是担心使用氟达拉滨作为清淋化疗的一部分,其40%经肾脏清除;大多数 CAR-T 研究传统上使用氟达拉滨和环磷酰胺清淋化疗,尽管也有部分研究单独使用环磷酰胺。因此斯坦福大学医学院Surbhi Sidana教授等假设,在根据肾功能调整清淋化疗(特别是氟达拉滨)剂量后,ide-cel CAR-T细胞治疗在伴有 RI 的多发性骨髓瘤 (MM) 患者中的疗效和安全性特征与不伴有 RI 的患者相似,并开展一项回顾性研究,旨在评价接受标准治疗 (SOC) ide-cel 治疗的伴RI 的 RRMM 患者的真实世界结局,研究结果近日发表于《Haematologica》。

研究方法
该回顾性、多中心、观察性研究纳入美国11家中心接受SOC ide-cel 治疗的伴RI和不伴RI的RRMM患者。根据Cockroft Gault方程,RI定义为CAR-T治疗时CrCl< 50mL/min,CrCl <30mL/min或正在接受透析定义为重度RI。根据机构指南进行清淋化疗给药和毒性管理。
研究结果
患者
11家中心共214例患者接受ide-cel,其中28例(13%)存在RI,包括其中11例(38%)为重度RI(1例正在接受透析)。表1描述了患者特征。RI 患者年龄更大(中位年龄 69 vs 63 岁,p=0.001),患者中女性更多 (68% vs 36%,p=0.001),R-ISS 3期患者更多(43% vs 24%,p=0.03),这是由于白蛋白水平更低和β-2-微球蛋白水平更高所致。整体队列中33%的患者为高危细胞遗传学,且RI患者中高危细胞遗传学的患者比例更高 (48% vs 21%,p=0.09)。基线时RI患者的血小板计数较低,32%的患者血小板<50000/uL(3级或4级血小板减少),而肾功能正常组为17%(p=0.06)。RI 患者既往接受过更多治疗,中位治疗线数为8,而无 RI 患者既往接受过6线治疗(p=0.03)。此外,五药难治性疾病 (36% vs. 45%,p=0.4) 或既往暴露于另一种 BCMA 靶向治疗(各25%,p>0.9)的患者比例无差异。
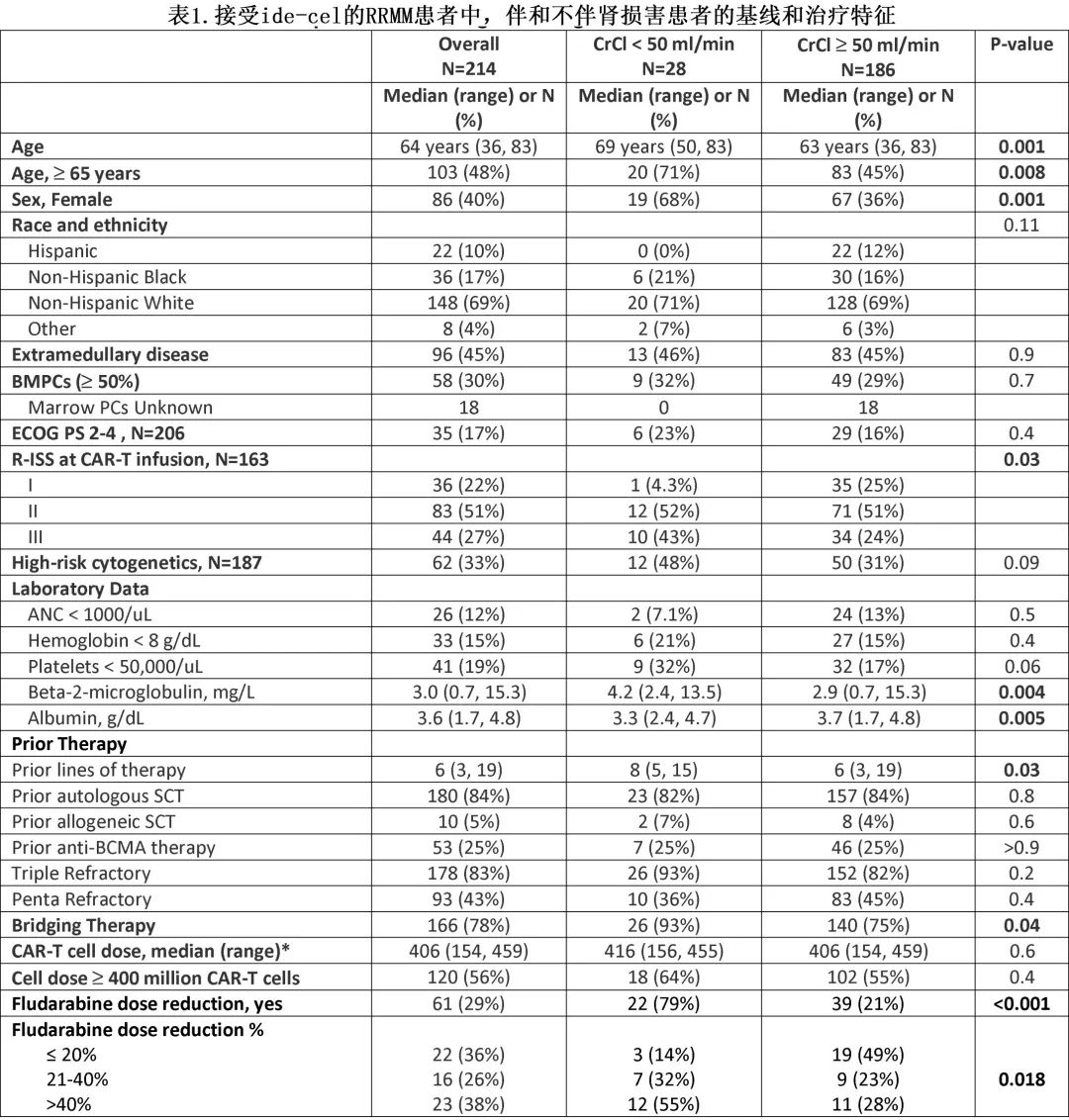
桥接治疗在 RI 患者中更常用 (93%vs 75%,p = 0.04)。氟达拉滨剂量降低在 RI 患者中更常见 (79% vs 21%,p<0.001)。在接受氟达拉滨减量的 RI 患者中,86%的患者减量>20%。CAR-T细胞输注剂量(中位数:4.16 vs 4.06亿个细胞)或接受≥4亿个 CAR-T 细胞的患者比例无差异。
安全性
表2为伴和不伴 RI 患者接受 CAR-T 细胞治疗后发生的毒性。RI 患者的 CRS 发生率、严重程度和发生时间与无 RI 患者相似(任何级别CRS:89% vs 84%,p=0.8;≥3级:7% vs 2%,p=0.2)。两组至 CRS 最大严重程度的中位时间均为1天。同样,RI患者的 ICANS 发生率和严重程度与无 RI 患者也相当(任何级别ICANS:23% vs 20%,p=0.8;≥3级:12% vs 6%,p=0.2)。RI 患者的住院时间更长(中位数:13.5天 vs 9 天,p=0.03),入住重症监护室的发生率有升高趋势 (18% vs 8%,p=0.07);托珠单抗 (79% vs 68%,p=0.3) 或anakinra的使用 (4% vs 5%,p>0.9) 相似,但RI患者有使用类固醇较多的趋势 (43% vs 26%,p=0.07)。有和无 RI 患者的感染率相似 (43% vs. 31%,p=0.2)。
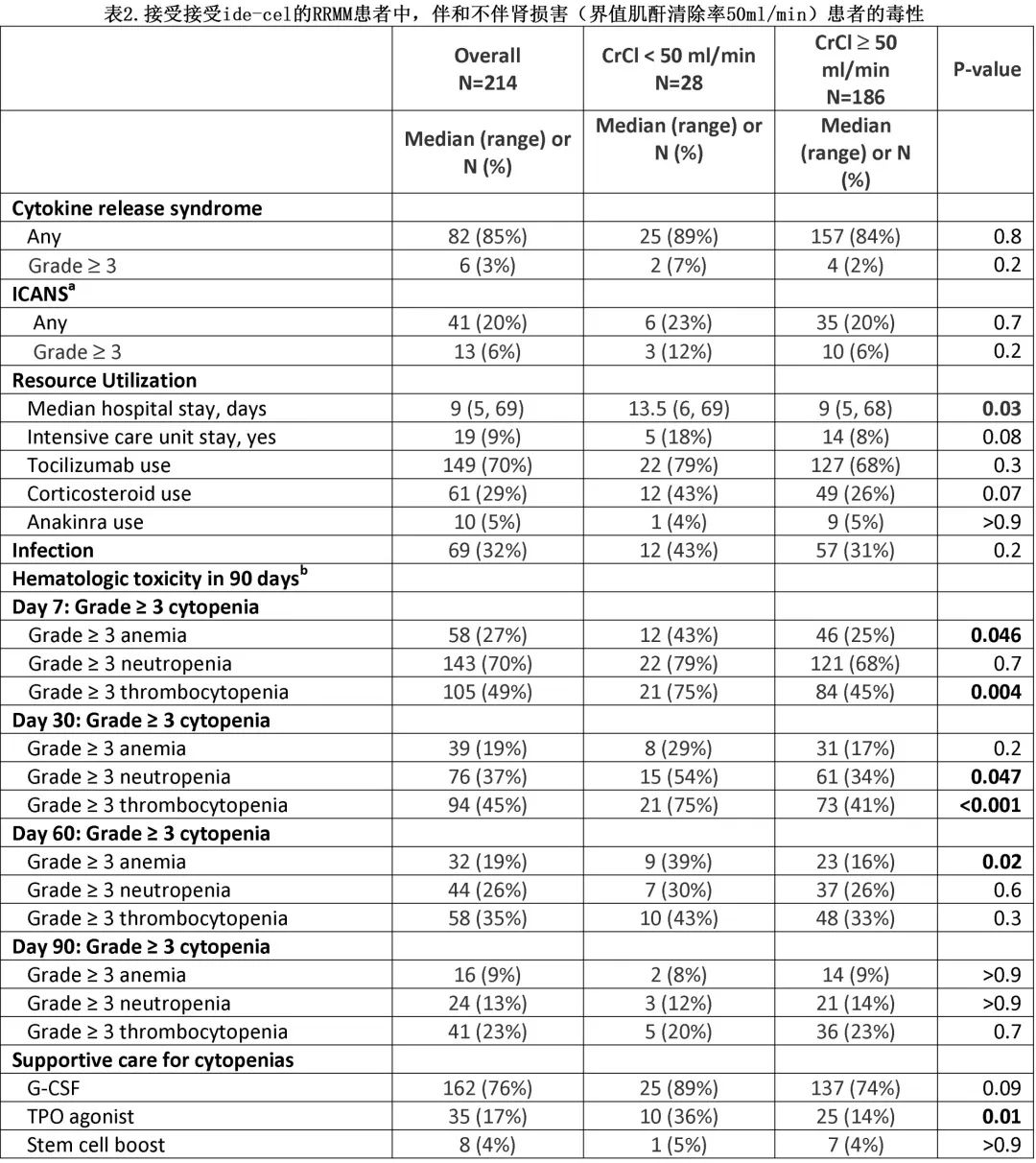
在第7天,RI患者的重度血细胞减少发生率更高,包括≥3级贫血 (43% vs 25%,p=0.046) 和≥3级血小板减少 (75% vs 45%,p=0.004);CAR-T 后第30天,RI患者的血细胞减少持续更严重,≥3级中性粒细胞减少 (54% vs 34%,p = 0.047) 和≥3级血小板减少 (75% vs 41%,p<0.001) 的发生率更高。血细胞减少症随时间推移和 CAR-T 后3个月恢复,两组之间≥3级血细胞减少症无差异。RI 患者需要更多的血细胞减少支持治疗,血小板生成素 (TPO) 激动剂的使用率更高 (36% vs 14%,p=0.01),粒细胞集落刺激因子的使用率有升高趋势 (G-CSF,89% vs 74%,p=0.09)。干细胞增强的使用无差异 (5% vs 4%,p>0.9)。
当按重度RI(CrCl<30 mL/min或透析依赖性)、中度 RI(CrCl 30-49 mL/min) 和无RI(CrCl≥50 mL/min)分析三组的肾功能时,安全性结局遵循相似的趋势。
部分患者的肾功能改善;重要的是任何基线 RI 患者的肾功能均未恶化。在具有配对基线和第30天数据的患者中, CrCl 介于 30-49 mL/min 的患者 (N=16)没人在第30天发生 CrCl 恶化至<30 mL/min,16例患者中的12例仍在同一肾功能组(CrCl介于30-49 mL/min),另4例肾功能改善至CrCl≥50 mL/min。在10例CrCl<30 mL/min的患者中,3例患者的 CrCl 改善至30-49 mL/min,而7例患者在第30天的 CrCl 相似。在 CAR-T 时CrCl≥50 mL/min的167例患者中,11例患者 (7%) 在 CAR-T 后第30天肾功能恶化(CrCl<30 mL/min,n=5和CrCl 30-49 mL/min,n=6)。
疗效
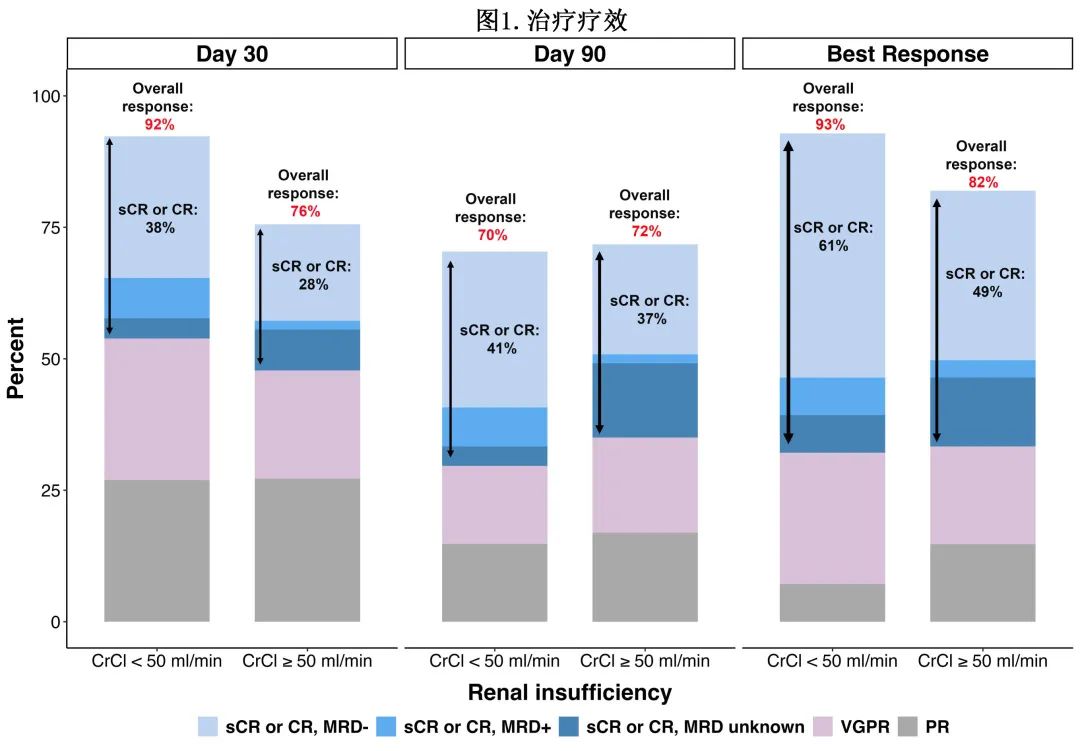
缓解率:有和无 RI 的患者缓解率相似,如图1所示。在第30天,有和无 RI 患者的ORR分别为92% vs 76%(p=0.06),≥CR率分别为38% vs 28%(p=0.3)。当考虑任何时间的最佳缓解时,ORR为93% vs 82%(p=0.2),CR率为61% vs 49%(p=0.2)。
生存期:队列的中位随访时间为9.6个月。肾功能不影响 PFS 或OS(图2)。伴和不伴 RI 患者的中位 PFS 分别为9个月和8 个月(p = 0.28),中位OS为未达到和15.5个月(p=0.25)。
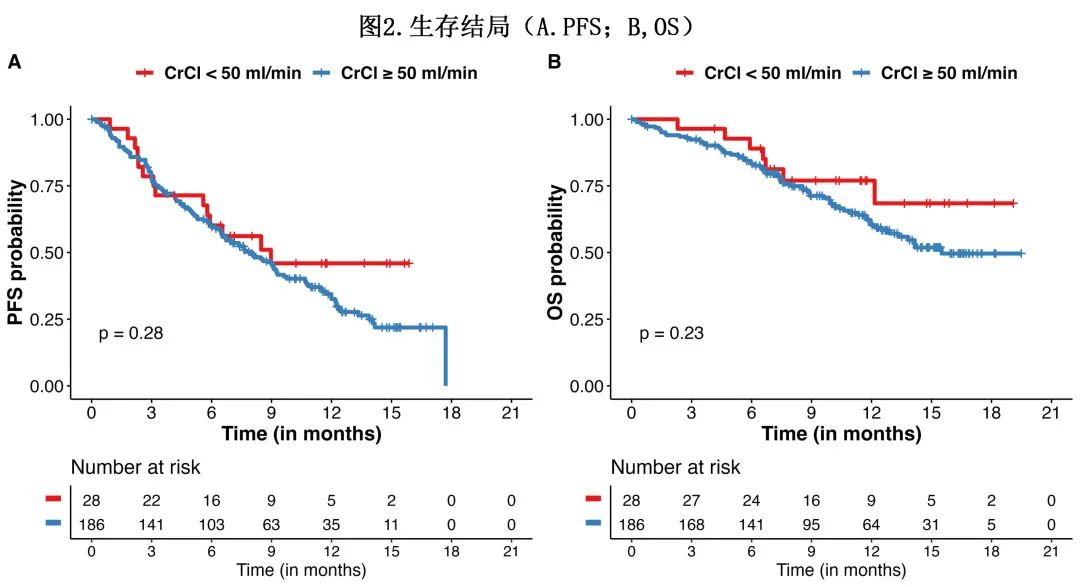
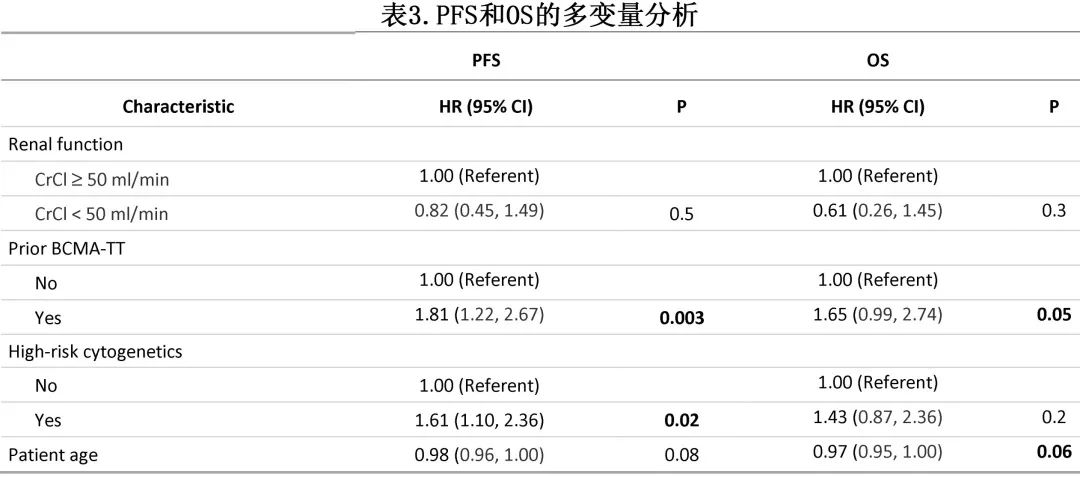
在多变量分析中(表3),RI并非 PFS 的独立预测因素 (HR=0.82,p=0.5),而高危细胞遗传学和既往 BCMA 治疗是独立的不良预后因素;RI也并非 OS 的独立预测因素 (HR=0.61,p=0.3),而既往 BCMA 治疗和年龄年轻是独立的不良预后因素。
当将肾功能分为三组进行分析时:重度RI(CrCl<30 mL/min或透析依赖)、中度 RI(CrCl30-49 mL/min) 和无RI(CrCl≥50 mL/min),也观察到相似的结果,包括多变量分析在内,三组之间的 PFS 和 OS 没有差异。
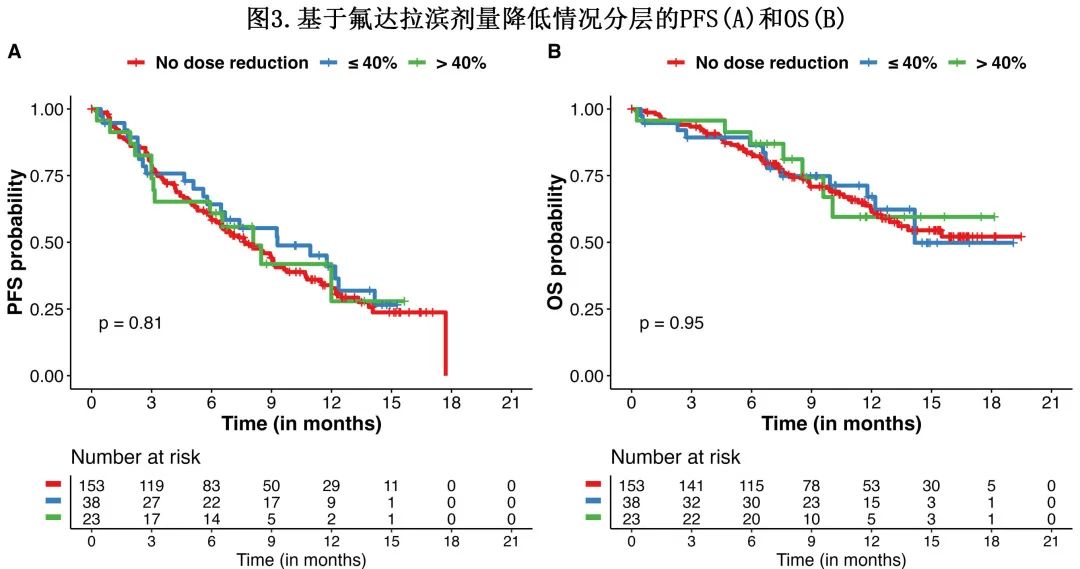
如图3所示,氟达拉滨剂量降低不影响 PFS 或OS:剂量未降低、剂量降低达40%和剂量降低超过40%的患者的中位 PFS 分别为7.7 vs 9.3 vs 8.1个月(p=0.81)。
CrCl临界值45ml/min进行的亚组分析
由于ide-cel的关键研究排除了CrCl<45 mL/min的患者,因此使用该肌酐清除率临界值对 ide-cel 的安全性和疗效进行了亚组分析,结果仍相似。基线特征和安全性差异与使用 50mL/min 肌酐清除率临界值的分析相当,两组间缓解率、PFS和 OS 也相似。
总结
该大型回顾性研究是首个报道伴肾损害RRMM患者接受BCMA CAR-T治疗结局的队列研究。作者评价了接受标准治疗 ide-cel 治疗的伴肾损害的RRMM患者,因为 CAR-T 治疗在该人群中的结局未知。RI 定义为肌酐清除率 (CrCl<50 mL/min);CrCl<30 mL/min或透析依赖定义为重度RI。研究队列包括214例患者,28例(13%)为 RI 患者,包括11例重度 RI 患者(其中透析患者1例)。RI患者年龄较大,更可能为女性,患 R-ISS 3 期疾病的可能性更高。伴和不伴 RI 患者中 CRS(89% vs 84%,≥3级:7% vs 2%)和ICANS (23% vs 20%,≥3级:12% vs 6%) 发生率和严重程度相似。RI 患者短期≥3级血细胞减少的发生率较高,但CAR-T 后3个月血细胞减少相似。RI患者 CAR-T 后肾功能未恶化。伴和不伴 RI 患者的缓解率 (93%vs 82%) 和生存结局(中位PFS:9 vs 8个月,p=0.26)相当。
总的来说,ide-cel 治疗在 RI 患者中是可行的,其安全性和疗效特征与无 RI 患者相当,但短期高级别血细胞减少和住院时间高于无RI患者。作者认为,这类患者不应从多发性骨髓瘤的CAR-T临床试验中排除。
参考文献
Sidana S,et al. Idecabtagene vicleucel chimeric antigen receptor T-cell therapy for relapsed/refractory multiple myeloma with renal impairment.Haematologica . 2023 Sep 21. doi: 10.3324/haematol.2023.283940.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











不错,学习了。
40