【JHO】BCMA CAR-T最长随访:LEGEND-2研究5年随访结果
2024-05-07 聊聊血液 聊聊血液 发表于上海
近日《Journal of Hematology & Oncology》发表了该研究随访65.4个月的结果,也是靶向BCMA CAR-T随访最久的报道。
LEGEND-2研究
西达基奥仑赛(Ciltacabtagene autoleucel,cilta-cel,LCAR-B38M) 是传奇和强生合作开发的靶向BCMA CAR-T细胞产品,其治疗复发和难治性多发性骨髓瘤(RRMM)的关键研究CARTITUDE-1和CARTIFAN-1证明了其深度和持久的疗效和可控的安全性。CARTITUDE-2队列B研究用于一线治疗后早期复发患者,总缓解率(ORR)为100%。CARTITUDE-4研究的最新数据表明,在既往一至三线治疗的来那度胺难治性患者中,西达基奥仑赛优于标准治疗。

LEGEND-2研究是在中国4家中心开展的西达基奥仑赛首项中国I期研究,在中位4年随访时,中位无进展生存期(PFS)为18个月,中位总生存期(OS)未达到。近日《Journal of Hematology & Oncology》发表了该研究随访65.4个月的结果,也是靶向BCMA CAR-T随访最久的报道。

研究结果
患者特征
研究共入组74例RRMM患者。患者既往接受过烷基化剂和/或含蒽环类药物化疗(93.2%)和蛋白酶体抑制剂(PI)和/或免疫调节剂(IMiDs)(95.9%),24.3%接受过自体造血干细胞移植。既往治疗中位数为3线。患者年龄27~74岁,中位数54.5。16.2%的患者ECOG体能状态较差(≥2分)。IgG亚型最多(44.6%),其次为IgA亚型(28.4%)和轻链亚型(25.7%)。在肿瘤负荷和骨髓瘤生物学方面,28.4%的患者为ISS III, 75.7%的病例为Durie-Salmon III期。基线时29.7%存在髓外浆细胞瘤。42例患者存在细胞遗传学异常(CA)信息,包括t(4;14)、t(14;16)、t(14;20)、del(17p)、gain(1q),其中78.6%的患者为高危CA。根据mSMART风险分层,42例患者中分别有23.8%和2.4%分别为双打击和三打击。血清β2微球蛋白平均水平为5.8 mg/L。详情如表1所示。

缓解率与患者特征
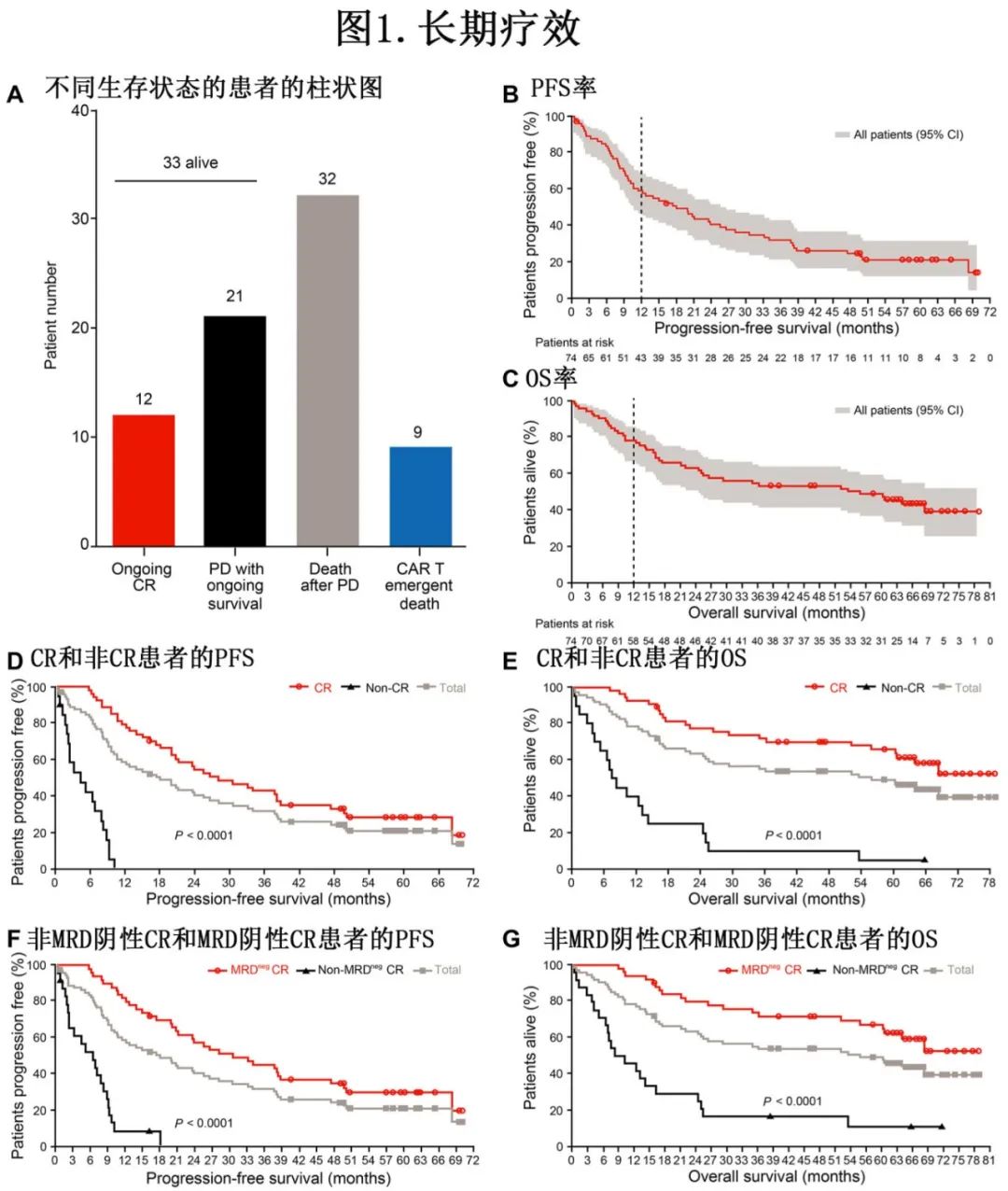
ORR为87.8%(65/74例);54例(73.0%)患者获得完全缓解(CR),50例(67.6%)患者获得MRD阴性深度缓解(< 10-4)。数据截止时33例(44.6%)患者仍然存活,且12例(16.2%)保持CR未复发,最长的缓解期为6.4年。62例患者发生疾病进展(PD)和/或死亡,包括53例在≥部分缓解(PR)后出现PD。32例死于PD,9例因未复发事件死亡。21例PD患者在接受后续治疗后持续生存(图1A)。
与PD/死亡患者相比,持久缓解的患者更多为基线体能状态良好(ECOG 0分)、IgG MM亚型和无髓外病变;轻链型MM患者预后较差,但无统计学差异。此外,高危CA并非不良预后因素。使用氟达拉滨和环磷酰胺联合预处理策略可能优于单独使用环磷酰胺 (表1)。
长期疗效
中位随访时间为65.4个月,所有治疗患者的5年PFS率为21.0% (图1B), 5年OS率为49.1% (图1C);随着时间的推移,PFS和OS曲线逐渐变平。65例缓解者的5年PFS和OS率分别为23.6%和55.9%。54例CR患者的生存状况进一步改善,5年PFS和OS率分别为28.4%和65.7%,均显著高于未达到CR的患者(p<0.0001,图1D和E)。与MRD阳性患者相比,MRD阴性患者的获益更为明显(p<0.0001,图1F和G)。在数据截止时,24.0%(12/50)的MRD阴性缓解者仍处于深度、持续缓解。
中位PFS和中位OS分别为18.0和55.8个月。对于达到CR和MRD阴性CR的患者,中位PFS分别延长至28.2个月和30.6个月,且中位OS未达到。而未获得≥CR的患者表现出较差的结局,中位PFS仅为4.4个月,中位OS为7.9个月。所有患者的中位缓解持续时间(DOR)为23个月,且MRD阴性缓解者的中位DOR明显高于其他缓解者(32.7个月对7.5个月,p<0.0001)。这些数据表明,深度缓解患者更有可能获得良好结局。
为评估早期良好缓解是否会导致持久环节,评估至缓解时间与缓解持续时间之间的关系。结果表明,较长时间达到最佳缓解(≥3.3个月)的患者与在3.3个月内达到最佳缓解的患者相比,PFS和OS更长(图2A和B)。较晚达到最佳缓解与IgG亚型和较高的ISS分期相关。

正常Ig恢复代表了获得缓解的患者体液免疫的稳定状态。在26例有Ig数据的CR患者中,21例血清Ig水平恢复正常;只有1例患者的Ig水平在5.4年时恢复正常,其余20例患者在5年内恢复正常。至完全恢复的中位时间为16.7个月,最早出现于输注后9.1个月。所有持续无复发的患者血清Ig均恢复,意味着体液免疫完全恢复。21例Ig完全恢复的CR患者的5年OS率为100%,但与5例Ig水平异常的患者相比没有显著差异,可能是因为样本大小不平衡(p=0.14,补充图3)。Ig水平正常的CR患者未报告严重感染。
5年缓解期后仍存在进展风险。3例达到MRD阴性CR的患者在输注后68.3、69.5和62.4个月出现疾病复发;1例患者发生髓外病变但BM未检测到肿瘤,2例患者单克隆副蛋白水平升高。所有患者都进行了后续治疗。
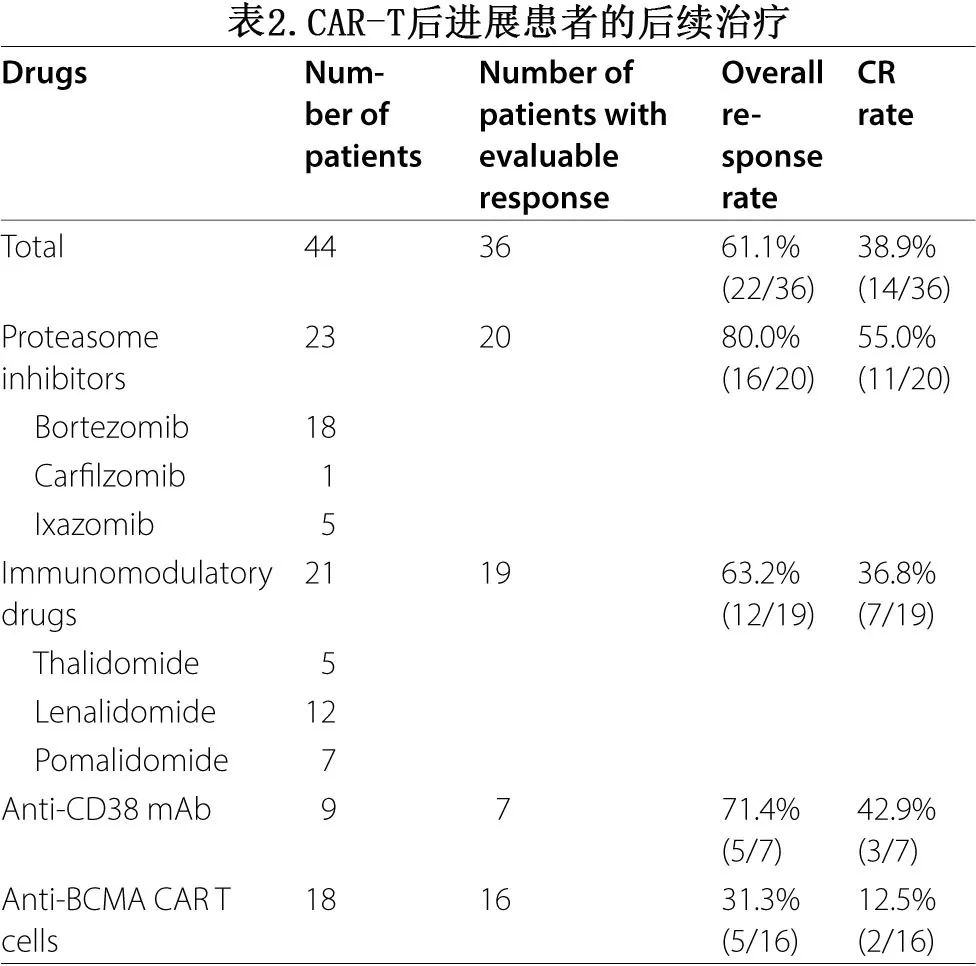
53例进展的患者中有44例接受了后续治疗,最常见的为PI,其次为IMiDs、BCMA CAR-T细胞产品和抗CD38单克隆抗体(表2)。在36例有缓解数据的患者中,22名(61.1%)患者对CAR-T后挽救治疗反应,获得≥PR;以PI为基础的方案ORR最高(80.0%),CR最高(55.0%)。抗BCMA CAR-T挽救治疗仅使31.3%的患者受益,低于既往CAR-T治疗的ORR 87.8%(表2)。大多数获得二次缓解的患者接受了维持治疗;2例患者在通过自体造血干细胞移植或抗BCMA CAR-T干预获得CR后停止治疗。重要的是,21例患者在PD后额外存活了两年以上。
长期安全性
所有患者在治疗的第一个月均发生治疗后出现的不良事件(TEAE)。细胞因子释放综合征(CRS)是最常见的TEAE,发生68例(91.9%);大多局限于低级别且均为临床可逆,大多数患者的CRS在CAR-T细胞输注后30天内消退,但有3例患者长期CRS,分别持续31天、37天和51天;没有观察到二次CRS。3/4级中性粒细胞减少症、血小板减少症和肝功能障碍发生率分别为85.3%、58.8%和38.3%。1例患者出现短暂的1级免疫效应细胞相关神经毒性综合征(ICANS)。一例患者在骨髓瘤进展后出现精神障碍后自杀身亡;患者无运动和神经认知TEAE异常。
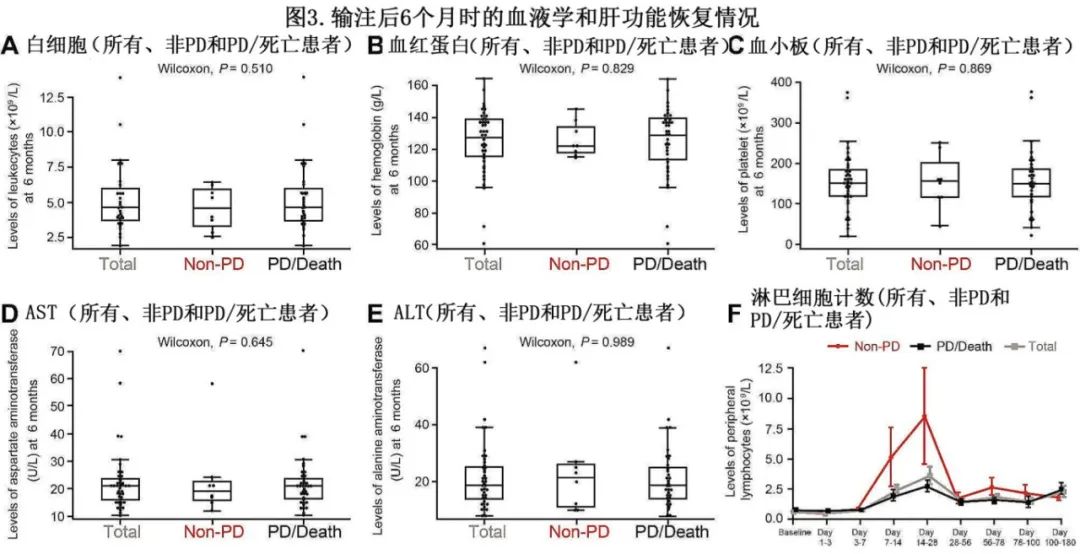
至输注后6个月,分别有47.3%、44.6%和59.5%的患者达到正常白细胞、血红蛋白和血小板水平,平均水平分别为4.7×109/L、125.3 g/L和155.0×109/L (图3A∼C)。天冬氨酸氨基转移酶(AST)和丙氨酸转氨酶(ALT)水平分别为中位21.0U/L和18.5U/L (图3D和E)。非PD和PD/死亡组在血液和肝脏功能恢复没有显著差异 (图3A∼E),表明安全性不影响患者的疗效结局。
随访6个月后观察到病毒再激活或感染,但未报告重度病例。带状疱疹病毒感染3例,乙型肝炎病毒感染1例;在给予抗病毒药物和Ig后康复。19名存活患者中获得了COVID-19感染病史数据,其中6例为阴性、13例在全球大流行期间(2020~2022年)感染。所有13例受影响患者均出现自限性症状,如低烧、咳嗽和疲劳,体征持续时间从1天到3天不等。无新冠肺炎相关肺炎和死亡报告。在常规试验中未检测到转基因特异性复制能力慢病毒。病毒感染情况下未见淋巴细胞不可控扩增。
数据截止时,4例患者在LCAR-B38M治疗后8~32个月发生肺、食管、宫颈第二原发恶性肿瘤。所有患者均获得骨髓瘤缓解,SPM检测时无并发血液学恶性肿瘤。3例患者最终死于SPM;1例宫颈癌治愈,但在输注后50.0个月MM复发,经硼替佐米和来那度胺治疗后达到CR。
CAR-T细胞动力学
在CAR-T细胞输注后长达180天的观察期内,平均循环淋巴细胞计数在14~28天达到峰值,并在1个月后逐渐下降(图3F)。尽管随着CAR-T的扩增,非PD组的平均淋巴细胞计数峰值趋向于高于PD/死亡组(图3F),但在具有可用转基因数据的16例患者中,LCAR-B38M的高峰水平与CR和持久缓解无关。
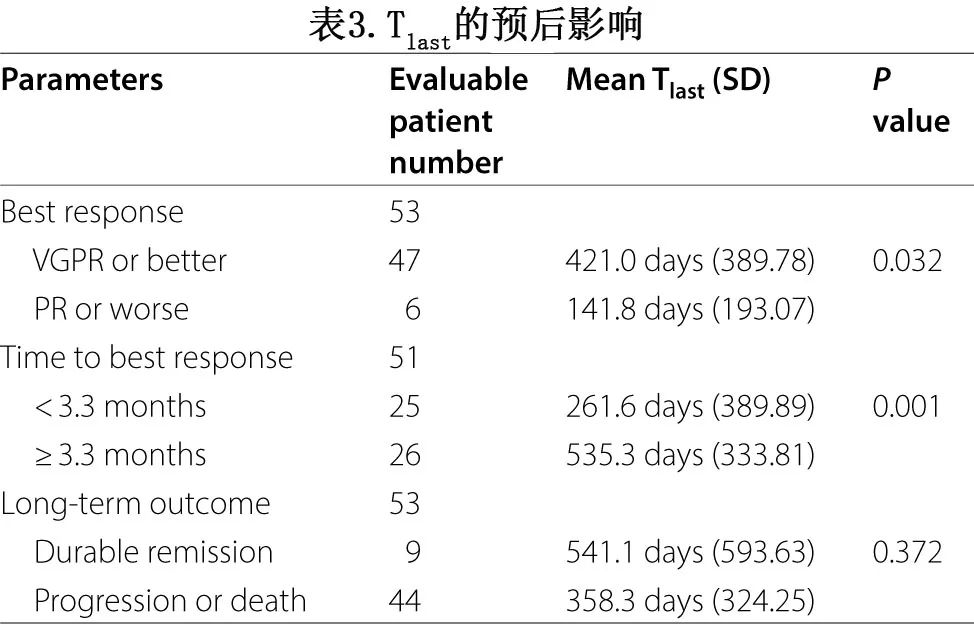
理论上,转基因持续时间长(Tlast)与有利结局有关。获得≥VGPR的患者与≤PR的患者相比,Tlast更长(中位数为421.0天 vs 141.8天,p=0.032)。值得注意的是,与较短时间达到最佳缓解的患者相比,较长时间达到最佳缓解的患者具有较长的CAR-T细胞持久性(中位261.6 vs 535.3天,p=0.001)。然而在长期观察中,CAR-T细胞的长期持久性并未带来持久缓解(表3)。
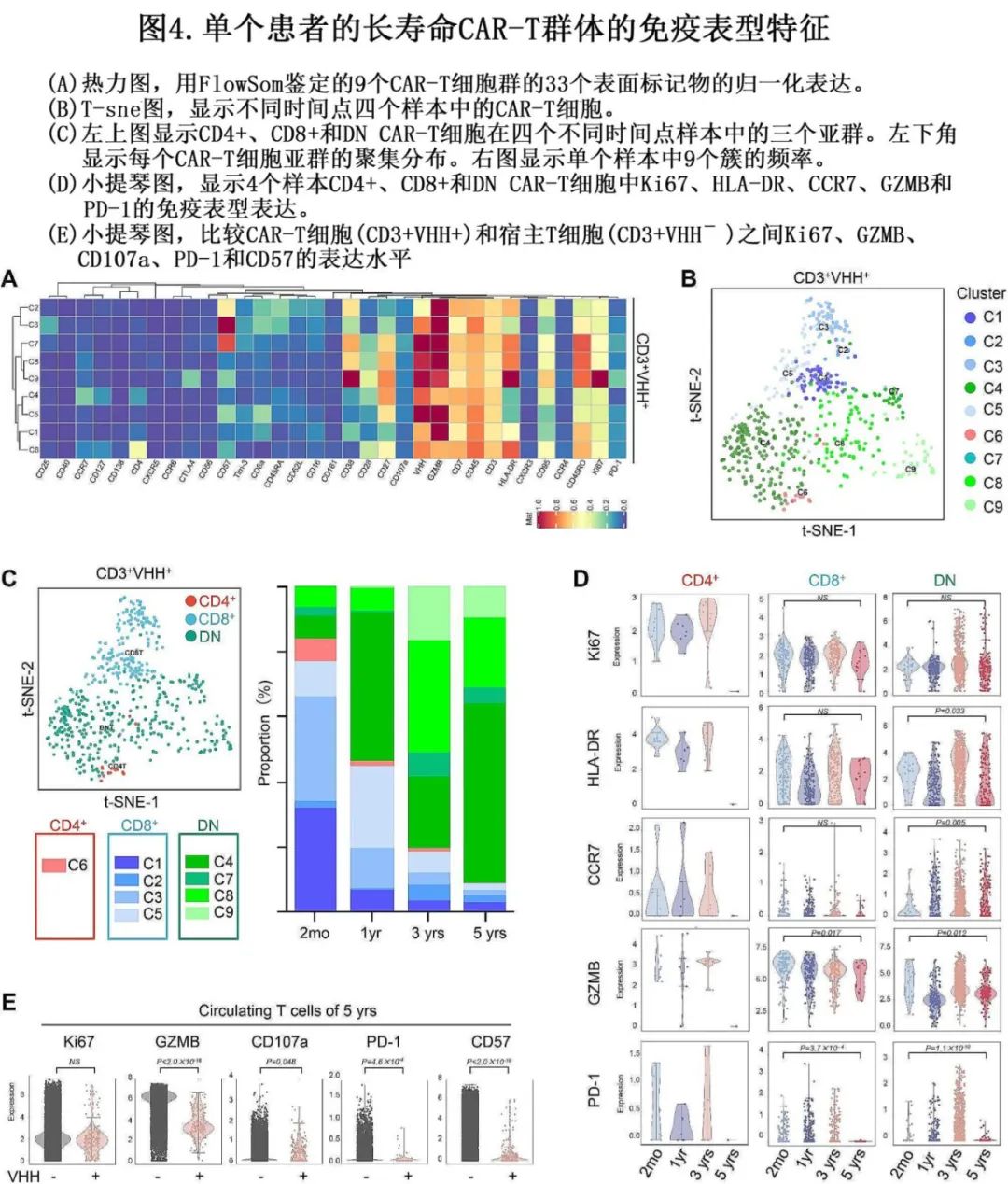
末次随访时,1例MRD阴性CR维持5.6年的患者中仍可检测到CAR-T细胞。使用41抗体panel,在输注后2个月、1年、3年和5年时检测持久存在的CAR-T细胞的免疫表型。抗amelid VHH抗体标记的CAR-T细胞在四个时间点分别占循环中CD45+有核细胞的3.01%、1.04%、0.49%和0.24%。根据标志物表达谱(图4A),使用T -sne聚类算法(图4B), CAR-T细胞可划分为9个簇(clusters,表示为C1~9);特征性标志物首先分为三个主要亚群:CD4+ (C6), CD8+ (C1~3,C5)和CD4- CD8-(C4,C7~9)(图4C)。令人惊讶的是,CD4- CD8-亚群随着时间的推移成比例地扩大,在5年时占所有CAR-T细胞的91.6%。CD8+亚群少于10%,CD4+工程细胞几乎检测不到(图4C)。与初始治疗阶段相比,CD4/CD8双阴性(DN) CAR T亚群在较晚的时间点表现出高水平的HLA-DR、CCR7、CD27、CD28和CD107a,相当水平的Ki67和CD38,以及低水平的GZMB、PD-1和Tim-3(图4D)。在CD8+亚群中,Ki67和HLA-DR水平在2个月和5年时相似,但GZMB和PD-1的表达在5年时下降(图4D)。与宿主T细胞(CD3+VHH-)相比,CAR-T细胞(CD3+VHH+)在5年时间点表现为规律性增殖(表现为Ki67适度表达)、功能性活化(PD-1和CD57下调)和低毒性(GZMB和CD107a表达降低)(图4)。
总结
LEGEND-2研究的65.4个月随访中,5年PFS和OS分别为21.0%和49.1%,随着时间的推移,生存曲线逐渐趋于平缓。CR患者的PFS和OS较长,5年生存率分别为28.4%和65.7%。12例患者(16.2%)保持CR未复发,与基线高危细胞遗传学异常无关,所有患者均恢复正常的体液免疫。持续CR与多个预后基线指标密切相关,包括良好体能状态、IgG亚型、无髓外病变以及环磷酰胺和氟达拉滨联合预处理策略。62例(83.8%)发生疾病进展(PD)和/或死亡,但61.1%的PD患者对后续治疗反应良好,其中以蛋白酶体抑制剂为主的方案获益最多。在安全性方面,非PD组和PD/死亡组之间血液学和肝功能恢复无显著差异。第二原发恶性肿瘤发生率低(5.4%),无重度病毒感染。COVID-19阳性患者仅出现自限性症状。此外,该研究描述了1例持续缓解患者的持续性CAR-T亚群,富含惰性增殖和低细胞毒性CD4/CD8双阴性功能性T淋巴细胞。
该数据是目前抗BCMA CAR-T细胞治疗RRMM的最长随访,表明西达基奥仑赛治疗晚期多发性骨髓瘤可获得长期缓解和生存。既往多线治疗的RRMM患者获得长期缓解,16%的患者在>5年随访后仍无复发。MM患者预后的改善有可能重塑抗骨髓瘤的治疗,并提高部分患者治愈的可能性。
参考文献
Xu, J., Wang, BY., Yu, SH. et al. Long-term remission and survival in patients with relapsed or refractory multiple myeloma after treatment with LCAR-B38M CAR T cells: 5-year follow-up of the LEGEND-2 trial. J Hematol Oncol 17, 23 (2024). https://doi.org/10.1186/s13045-024-01530-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#多发性骨髓瘤# #CAR-T# #西达基奥仑赛#
9