NEJM:塔拉妥单抗治疗先前治疗过的小细胞肺癌患者
2023-10-29 daikun MedSci原创 发表于湖北省
该研究旨在评估塔拉妥单抗治疗先前治疗过的小细胞肺癌患者的疗效和安全性,结果显示塔拉妥单抗每2周以10mg剂量给药,在先前治疗过的小细胞肺癌患者中显示出抗肿瘤活性,具有持久的客观反应且安全可控。
小细胞肺癌是一种侵袭性疾病,与较差的生存结果相关。尽管大多数广泛期小细胞肺癌患者对初始治疗有反应,通常会在几个月内出现疾病进展。二线治疗选择有限,反应持续时间短(范围3.6至5.3个月),总生存期很少超过8个月。
塔拉妥单抗是一款靶向DLL3和CD3的单克隆抗体,在先前治疗的小细胞肺癌患者中,塔拉妥单抗的1期剂量探索试验显示出令人鼓舞的抗肿瘤活性,中位反应持续时间为12.3个月。该研究报告了2期DeLLphi-301试验的结果,其中在先前治疗的广泛期小细胞肺癌患者中评估了两种不同剂量的塔拉妥单抗的抗肿瘤活性和安全性。

方法:DeLLphi-301是一项2期开放标签国际试验,旨在评估先前接受两种或多种治疗方案治疗的晚期小细胞肺癌患者的抗肿瘤活性,安全性,副作用和药代动力学。塔拉妥单抗每2周静脉注射一次,剂量为10mg或100mg,用于先前治疗的小细胞肺癌患者。主要终点是BICR根据RECIST v1.1评估的客观反应(完全或部分反应)。次要终点包括客观反应持续时间,无进展生存期,总生存期,治疗期间的不良事件。
1.人群和基线特征
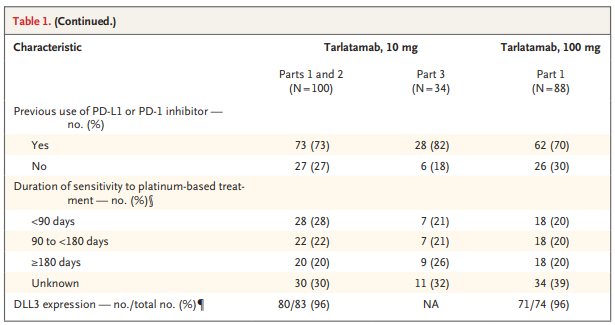
2021年12月至2023年5月,共有222名患者在17个国家的56个地点登记。在试验的第1部分中,176名患者被随机分配接受剂量为10 mg(88名患者)或100 mg(88名患者)的塔拉妥单抗。根据预先指定的中期分析结果,选择10 mg剂量用于第2部分(剂量扩展;招募了12名患者)和第3部分(缩短住院监测时间;招募了34名患者)。截至数据截止日期(2023年6月27日),10 mg组的中位治疗时间为5.1个月(范围0.0至15.2),100 mg组为3.7个月(范围0.0至15.2)。两个剂量组的基线患者的人口统计学和临床特征相似,不同之处在于100 mg组患者的脑转移率高于10 mg。

2.疗效分析
用于评估抗肿瘤活性的分析人群包括在第1部分中接受随机分组的所有176名患者和在第2部分中登记的12名患者。10 mg组的中位随访时间为10.6个月(95%置信区间[CI],9.2至11.3),100 mg组为10.3个月(95%置信区间,9.2至11.5)。通过BICR评估的客观反应患者百分比在10 mg组为40%(97.5%CI,29至52),在100 mg组为32%(97.5%CI,21至44(90%[68名患者中的61名]),在第一次计划评估时观察到反应,该评估发生在塔拉妥单抗治疗开始后6周(在±1周的窗口内)。在68例有客观反应的患者中,40例患者(59%)的反应持续时间至少为6个月,20例患者(29%)的反应持续时间至少为9个月。研究者和BICR反应评估一致。数据截止时,10 mg组40例患者中有22例(55%)和100 mg组28例患者中有16例(57%)正在进行客观反应。
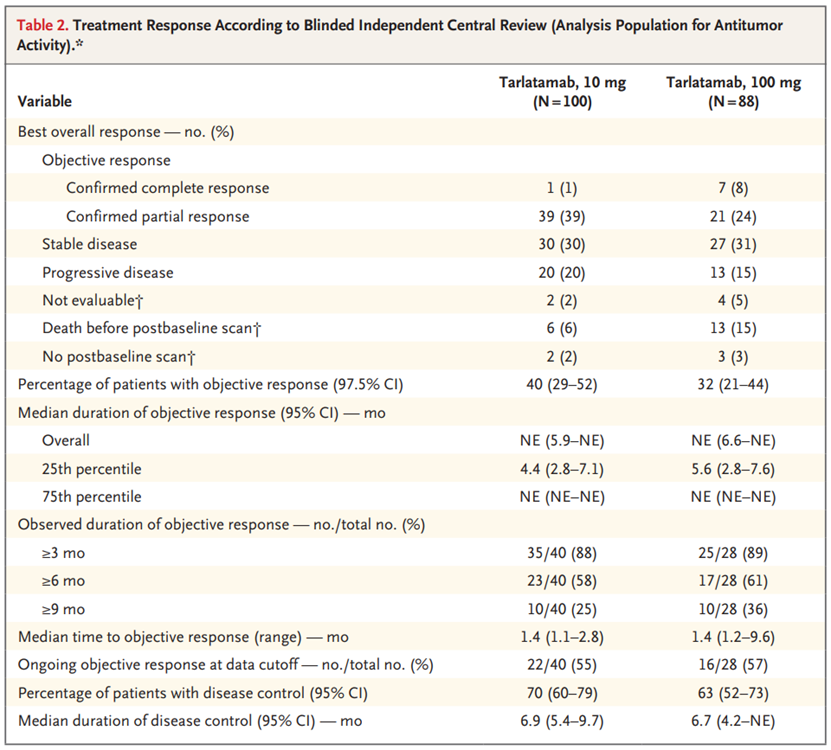
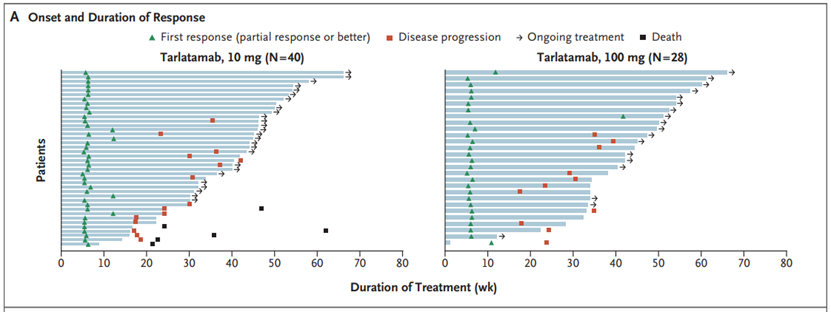
10 mg组的中位无进展生存期为4.9个月(95%CI,2.9至6.7),100 mg组为3.9个月(95%CI,2.6至4.4)。Kaplan-Meier估计,10 mg组6个月和9个月的无进展生存率分别为40%(95%CI,30-50)和28%(95%CI,19-38),100 mg组分别为34%(95%CI,24-45)和27%(95%CI,17-37)。Kaplan-Meier估计10 mg组6个月和9个月的总生存率分别为73%(95%CI,63-81)和68%(95%CI,57-77),100 mg组分别为71%(95%CI,60-80)和66%(95%CI,54-75)。在最后一次随访中存活的患者百分比在10 mg组中为57%(100名患者中的57名),在100 mg组中为51%(88名患者中的45名),总体生存数据尚未成熟。

3.安全性分析
治疗期间最常见的不良事件是细胞因子释放综合征(10 mg组51%,100 mg组61%),食欲下降(分别为29%和44%),发热(35%和33%),便秘(27%和25%)和贫血(26%和25%)。10 mg组59%的患者和100 mg组64%的患者发生3级或更高级别的不良事件。与治疗相关的3级或更高级别不良事件发生在10 mg组26%的患者和100 mg组33%的患者中。与治疗相关的不良事件导致10 mg组13%的患者和100 mg组29%的患者出现剂量中断,剂量减少或两者兼有。


结论:塔拉妥单抗每2周以10mg剂量给药,在先前治疗过的小细胞肺癌患者中显示出抗肿瘤活性,具有持久的客观反应和有希望的生存结果。没有发现新的安全信号。
原始出处:
Ahn M-J, et al. 2023. Tarlatamab for Patients with Previously Treated Small-Cell Lung Cancer. New England Journal of Medicine. DOI: 10.1056/nejmoa2307980.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言